Artikelen
Artikelen - Pyoderma gangrenosum: the good, the bad and the ugly (2019-03)
D.M.W. Balak
Pyoderma gangrenosum (PG) is een zeldzame neutrofiele dermatose die zich klassiek uit met pijnlijke ulceratieve huidafwijkingen met erythemateuze en ondermijnde wondranden gelokaliseerd aan de onderste extremiteiten. [1-3] Anders dan de naam doet vermoeden heeft PG geen infectieuze etiologie, maar betreft het een inflammatoire aandoening waarin auto-inflammatoire mechanismen waarschijnlijk een belangrijke pathofysiologische rol vervullen. [4]
Het stellen van de diagnose PG is niet eenvoudig door het ontbreken van pathognomonische of specifieke klinische en histopathologische kenmerken. PG wordt beschouwd als een diagnose per exclusionem, hoewel het uitsluiten van andere inflammatoire, infectieuze en ulceratieve aandoeningen in de praktijk lastig kan zijn door een grote overlap in klinische pre- sentatie. [5] Initiële misdiagnoses en vertraging in het stellen van de diagnose PG zijn daardoor veelvoorkomend en kunnen aanleiding geven tot significante morbiditeit. [6,7] Ook de behandeling van PG kan problemen opleveren. [8]
De afgelopen jaren zijn nieuwe bevindingen en observaties omtrent PG gepubliceerd. In dit artikel wordt een beknopt overzicht gegeven van de nieuwe inzichten die klinisch relevant zijn voor de diagnostiek en de behandeling van PG.
Kenmerken van pg
De meest voorkomende klinische presentatie van PG is een pustel of papel die zich in korte tijd ontwikkeld tot een pijnlijk ulcus met erythemateuze tot livedo gekleurde opgeworpen wondranden die tevens ondermijnd kunnen zijn. Twee andere bevindingen passend bij PG zijn pathergie, dat bij circa 20 tot 30% van de patiënten met PG wordt waargenomen, en syste- mische verschijnselen zoals koorts en verhoogde ontstekings- waarden in het bloed. [1]
Naast de klassieke ulceratieve vorm van PG worden nog drie andere klinische varianten onderscheiden: bulleuze, vegeta- tieve en pustulaire PG. De kenmerken van deze minder frequent voorkomende vormen van PG zijn samengevat in tabel 1. PG kan ook worden ingedeeld naar de lichaamslocatie die is aan- gedaan: peristomale, genitale, postoperatieve en extracutane PG. Postoperatieve PG ontstaat vaak binnen twee weken na mamma- of abdominale chirurgie en kan worden verward met een fasciitis necroticans. Extracutane PG is zeer zeldzaam en wordt gekenmerkt door steriele neutrofiele ontstekings- infiltraten die kunnen ontstaan in onder andere de longen. [9]
Tabel 1. Overzicht van verschillende klinische vormen van pyoderma gangrenosum. 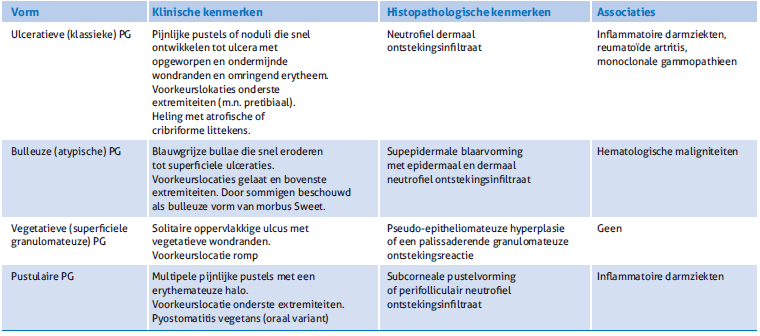
PG en andere aandoeningen
PG kan idiopathisch voorkomen, maar in circa 50% van de gevallen is PG geassocieerd met een onderliggend lijden. [1] De sterkste associaties zijn aangetoond voor inflammatoire darmziekten, (reumatoïde) artritis en hematologische malig- niteiten. In een Amerikaans retrospectief onderzoek bleek de associatie tussen comorbiditeit en het ontwikkelen van PG afhankelijk te zijn van de leeftijd. [10] Bij patiënten met PG jonger dan 65 jaar kwamen inflammatoire darmziekten frequent voor, terwijl patiënten ouder dan 65 jaar vaker een diagnose hadden van reumatoïde artritis, de ziekte van Bech- terew, maligniteit en hematologische aandoeningen. Minder frequent voorkomende associaties zijn gerapporteerd voor onder andere systemische lupus erythematodes (SLE), sarcoïdose en hepatitis C. [9]
PG kan in zeldzame gevallen voorkomen in het kader van een genetische auto-inflammatoire syndroom. Bij een combinatie van PG met (ernstig) acne, hidradenitis suppurativa en/of artritis moet hieraan worden gedacht. Drie auto-inflammatoire syndromen worden momenteel onderscheiden: het pyogenic arthritis, pyoderma gangrenosum, and acne (PAPA)-syndroom, het pyogenic arthritis, pyoderma gangrenosum, acne, and suppurative hidradenitis (PAPASH)-syndroom en het pyoderma gangrenosum, acne, and suppurative hidradenitis (PASH)-syn- droom. [11]
Diagnostische criteria voor pg
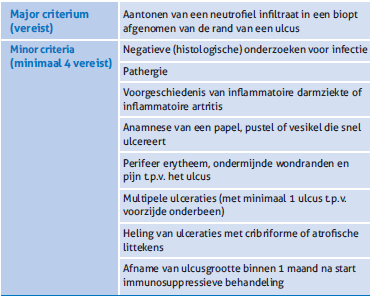
In 2018 publiceerde een internationale onderzoeksgroep criteria voor het stellen van de diagnose ulceratieve PG. [12] Via een delphimethode werd onder internationale experts consensus bereikt over een set van negen diagnostische criteria. De diagnose PG kan gesteld worden met één major criterium en minimaal vier van acht minor criteria, waarmee een sensitivi- teit van 86% en een specificiteit van 90% wordt bereikt (tabel 2). Deze criteria geven handvatten voor de praktijk en zijn behulp- zaam om af te stappen van PG als diagnose per exclusionem. Desalniettemin blijft het van belang om andere aandoeningen, zoals vasculitis, trombo-embolische oorzaken, maligniteit en infectie, zo goed mogelijk uit te sluiten. [13]
Tabel 2. Diagnostische criteria voor (ulceratieve) pyoderma gangrenosum zoals opgesteld door Maverakis et al. (2018). [12]
Strategieën bij verdenking op pg
De evaluatie van een patiënt met verdenking op PG is niet eenvoudig gezien de non-specifieke kenmerken van PG, de brede differentiële diagnose bij PG en de potentiële associatie met diverse interne aandoeningen.
Een volledige anamnese, lichamelijk onderzoek en histopa- thologisch onderzoek is aangewezen bij elke patiënt met verdenking op PG (figuur 1). Het histopathologisch onderzoek laat geen specifiek beeld zien voor PG, maar is noodzakelijk om andere diagnoses (in het bijzonder infectie en maligniteit) uit te sluiten. [1] Bepaling van bloedbeeld met differentiatie wordt aanbevolen als laboratoriumonderzoek. [10] Additioneel laboratoriumonderzoek naar onder andere ANCA, ANA en antifosfolipiden kan op indicatie worden verricht.
Verder aanvullend onderzoek naar een onderliggende interne aandoening wordt verricht met inachtneming van onder andere de leeftijd van de patiënt. [10] Het lijkt rationeel om bij patiënten onder de 65 jaar bij aanwijzingen voor een inflam- matoire darmziekte door te verwijzen naar een maag-darm- leverarts voor evaluatie en eventuele colonoscopie. Bij patiën- ten ouder dan 65 jaar dient een hematologische maligniteit/ aandoening uitgesloten te worden.
Behandeling van pg
De behandeling van PG is gestoeld op twee grote pijlers: remming van de neutrofiele inflammatie en wondgenezing. [1]
Initieel dient het doel van de behandeling het stoppen van de inflammatie te zijn; in tweede instantie moet de behandeling bij PG gericht zijn op wondgenezing. Er zijn meerdere behan- delopties beschreven voor PG, maar voor het merendeel van de behandelingen is de ondersteunende bewijskracht laag en consensusrichtlijnen ontbreken. Voor een optimaal manage- ment van PG is een multimodale behandeling aangewezen met het combineren van lokale therapie, optimaal wondver- zorgingsbeleid en op indicatie systemische immunosuppres- sieve therapie (tabel 3). Behandeling van een eventueel onder- liggende aandoening leidt tot betere uitkomsten voor PG. Lokale therapie is de aangewezen eerstelijnsbehandeling voor milde en gelimiteerde vormen van PG. Topicale corticos- teroïden zijn bij PG de meest beschreven lokale behandeling. Andere lokale behandelopties zijn intralesionale corticoste- roïden, topicale immunomodulatoren (tacrolimus zalf) en topicale ciclosporine.
Systemische corticosteroïden (dosering 0,5 tot 1,0 mg/kg lichaamsgewicht) vormen de hoeksteen in de systemische behandeling van PG. In geval van ernstige of snel uitbreidende vormen van PG zijn hogere doseringen (2,0 mg/kg verdeeld over twee doseringen per dag) en methylprednisolon per intraveneuze toediening een optie. Kenmerkend voor PG is een relatief snelle respons met afname van pijn en omringend erytheem binnen 1-2 weken na start van systemische immuno- suppressieve behandeling. Gezien het ontbreken van objec- tieve PG-uitkomstmaten zijn pijn en de mate van inflam- matie (i.e. de erythemateuze wondranden) momenteel de best beschikbare indicatoren om immunosuppressieve thera- pie gestaag af te bouwen. [1,14,15] Dit geldt vooral voor syste- mische corticosteroïden, waarbij de balans tussen werkzaam- heid en toxiciteit goed afgewogen dient te worden. Steroïdspa- rende eerstelijns systemische behandelopties zijn ciclosporine en anti-TNF-alfa biologics. In een pragmatische gerandomi- seerde trial uit Engeland bleek systemische corticosteroïden (0,75 mg/kg lichaamsgewicht per dag) en ciclosporine per os (4 mg/kg lichaamsgewicht per dag) vergelijkbaar qua werk- zaamheid en snelheid van respons. [16]
De lijst met tweedelijnstherapieën voor PG is groot en omvat onder andere methotrexaat, azathioprine, dapson, intraveneus immunoglobulines, interleukine-1-antagonisten en interleu- kine-12/23-antagonisten. [17]
Tabel 3. Overzicht van verschillende behandelopties voor pyoderma gangrenosum.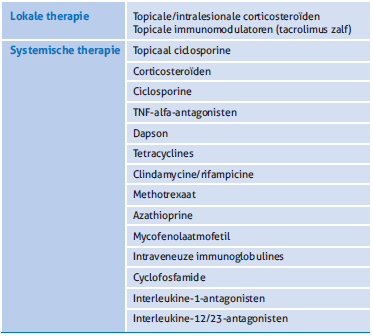
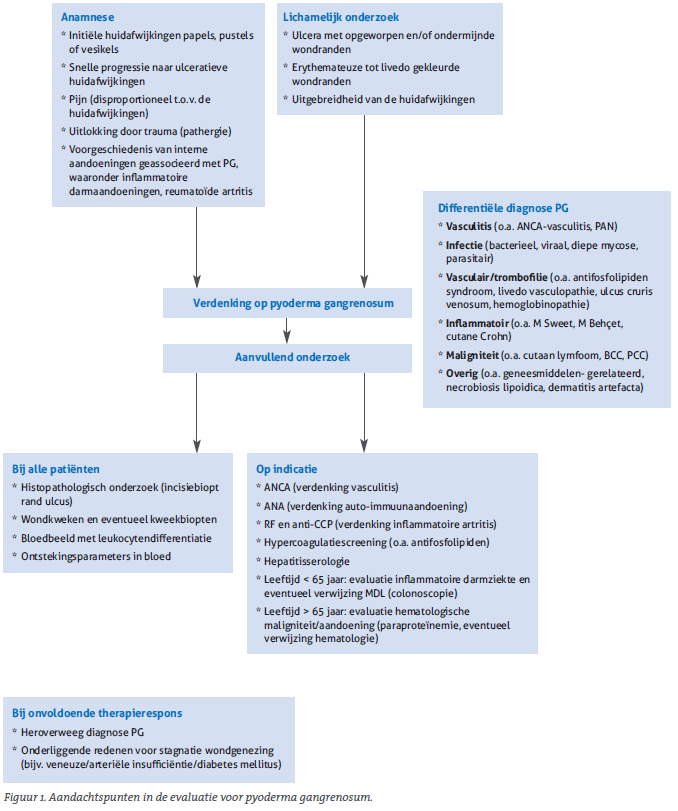
Figuur 1. Aandachtspunten in de evaluatie voor pyoderma gangrenosum.
Conclusies
Pyoderma gangrenosum is een zeldzame neutrofiele derma- tose die kan voorkomen als geïsoleerde aandoening, in associ- atie met een onderliggende interne aandoening, of in het kader van een genetische auto-inflammatoir syndroom. Tijdige herkenning en behandeling van PG voorkomt morbiditeit maar blijkt in de praktijk niet eenvoudig. Door een toename in wetenschappelijke interesse voor PG zullen voortschrijdende inzichten hopelijk gaan leiden tot betere diagnostische en therapeutische mogelijkheden voor PG.
Literatuur
- Ashchyan HJ, Nelson CA, Stephen S, James WD, Micheletti RG, Rosenbach M. Neutrophilic dermatoses: Pyoderma gangrenosum and other bowel- and arthritis-associated neutrophilic dermatoses. J Am Acad Dermatol 2018;79(6):1009-22.
- Su WP, Davis MD, Weenig RH, Powell FC, Perry HO. Pyoderma gangre- nosum: clinicopathologic correlation and proposed diagnostic criteria. Int J Dermatol 2004;43(11):790-800.
- Brooklyn T, Dunnill G, Probert C. Diagnosis and treatment of pyo- derma gangrenosum. BMJ. 2006;333(7560):181-4.
- Wallach D, Vignon-Pennamen MD. Pyoderma gangrenosum and Sweet syndrome: the prototypic neutrophilic dermatoses. Br J Derma- tol 2018;178(3):595-602.
- Weenig RH, Davis MD, Dahl PR, Su WP. Skin ulcers misdiagnosed as pyoderma gangrenosum. N Engl J Med 2002;347(18):1412-8.
- Ahn C, Negus D, Huang W. Pyoderma gangrenosum: a review of patho- genesis and treatment. Expert Rev Clin Immunol 2018;14(3):225-33.
- Haag CK, Nutan F, Cyrus JW, et al. Pyoderma gangrenosum misdiag- nosis resulting in amputation: A review. J Trauma Acute Care Surg 2018 Oct 23.
- Alavi A, French LE, Davis MD, Brassard A, Kirsner RS. Pyoderma gangrenosum: An update on pathophysiology, diagnosis and treatment. Am J Clin Dermatol 2017;18(3):355-72.
- Callen JP. Pyoderma gangrenosum. Lancet 1998;351(9102):581-5.
- Ashchyan HJ, Butler DC, Nelson CA, et al. the association of age with clinical presentation and comorbidities of pyoderma gangrenosum. JAMA Dermatol 2018;154(4):409-13.
- Cugno M, Borghi A, Marzano AV. PAPA, PASH and PAPASH Syndromes: pathophysiology, presentation and treatment. Am J Clin Dermatol 2017;18(4):555-62.
- Maverakis E, Ma C, Shinkai K. Diagnostic criteria of ulcerative pyo- derma gangrenosum: A Delphi consensus of international experts. JAMA Dermatol 2018;154(4):461-6.
- Ashchyan HJ, Nelson CA, Stephen S, James WD, Micheletti RG, Rosen- bach M. In response to: “New validated diagnostic criteria for pyo- derma gangrenosum”. J Am Acad Dermatol 2018. pii: S0190- 9622(18)33083-4.
- Dorrell DN, Huang WW. Assessing the severity of pyoderma gangre- nosum: a need for validated measurement tools. Br J Dermatol 2019;180(1):217-8.
- Wilkes SR, Williams HC, Ormerod AD, et al. United Kingdom dermato- logy clinical trials network STOP GAP team. Is speed of healing a good predictor of eventual healing of pyoderma gangrenosum? J Am Acad Dermatol 2016;75(6):1216-20.e2.
- Ormerod AD, Thomas KS, Craig FE, et al. UK Dermatology clinical trials network’s STOP GAP Team. Comparison of the two most com- monly used treatments for pyoderma gangrenosum: results of the STOP GAP randomised controlled trial. BMJ;350:h2958.
- Mekkes JR. Treatment of pyoderma gangrenosum. BMJ 2015;350:h3175.
Correspondentieadres
Deepak Balak
E-mail: d.m.w.balak@umcutrecht.nl