Artikelen
Artikelen SNNDV themadag - Vasculitis: pathofysiologische aspecten (2019-02)
Artikel in PDF
H.B. Thio
Vasculitis is een primair ziekteproces of secundair aan een andere immunologisch gemedieerde inflammatoire aandoening, zoals lupus erythematosus of reumatoïde artritris.Vasculitis kan tot de huid beperkt zijn, klinisch meestal in de vorm van purpura, maar is vaak een systemisch gebeuren. Primaire systemische vasculitis (PSV) vertegenwoordigt een spectrum van inflammatoire vasculaire aandoeningen die meestal worden geclassificeerd op basis van de grootte van het aangedane bloedvat: grote-, middelgrote- en kleinevatenvasculitis.
Er zijn verschillende onderliggende pathofysiologische mechanismen bij vasculitis betrokken waarbij de primair initiërende gebeurtenis(sen) vaak niet bekend is (zijn). Een combinatie van infectieuze of andere ‘triggerende’ omgevingsfactoren en een basis van genetisch bepaalde gevoeligheid wordt momenteel gezien als een belangrijk primair pathogenetisch proces dat uiteindelijk leidt tot vasculaire schade. Epigenetische mechanismen zoals methylatie van DNA, histonveranderingen in de vorm van acetylatie en niet-coderende RNA (miRNA), zijn essentieel om specifieke omgevingsfactoren om te zetten in fenotypische effecten. Hierdoor worden het niet-specifieke aangeboren (innate) en het specifieke adaptieve immuunsysteem geactiveerd om bloedvaten inflammatoir aan te vallen. Dit leidt tot een immunologisch gemedieerde inflammatoire vasculaire schade die uiteindelijk een disfunctie veroorzaakt van multipele organen. Systemische vasculitis wordt dan ook gekenmerkt door een gevarieerd klinisch ziektebeeld met diverse klinische symptomen (figuur 1). De systemische vasculitiden zijn in de beginfase vaak moeilijk te herkennen en te classificeren. Verder diepergaand begrip van de (immuno)pathogenese van vasculitis zal moeten leiden tot vroegere ziekteherkenning en uiteindelijk ook tot de ontdekking van nieuwe, effectieve en veilige biologische therapieën.
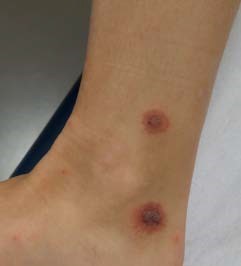
23-jarige vrouw met rode perimalleolair gelokaliseerde huidafwijkingen
Immunologie
De biologische wisselwerking tussen leukocyten en het bloedvatendotheel vormt de basis van alle inflammatoire processen in het algemeen en dus ook van vasculitis. Cytokinegeïnduceerde endotheelcelactivering en leukocyten-endotheelinter acties zijn minutieus gecoördineerde ontstekingsprocessen. Vorming en depositie van immuuncomplexen zijn essentieel in de pathogenese van de kleinevatenvasculitis in immuno-globuline A-vasculitis (henoch-schönleinpurpura), antiglomerulaire basaalmembraanziekte, cryoglobulinemische vasculitis en hypocomplementaire urticariële vasculitis. De beschikbare klinische en experimentele gegevens suggereren, maar zijn niet volledig definitief bewijzend, dat antineutrofielencytoplasma-antilichamen (ANCA’s) gericht tegen proteïnase-3 en myeloperoxidase daadwerkelijk pathogenetisch zijn in de ANCA-geassocieerde kleinevatenvasculitiden (AAV). Hoewel ANCA zijn effecten uitoefent via neutrofielenactivatie, is er steeds meer bewijs dat monocyten, lymfocyten en de alternatieve route van het complementsysteem eveneens betrokken zijn bij de immunopathogenese van AAV. [1-3] Bij AAV zijn er steeds meer aanwijzingen voor een pathogenetische rol van het complementsysteem (figuur 2). [2,3] Het blokkeren van C5a lijkt een veelbelovende strategie voor de behandeling van AAV te worden. Onder de lymfocyten hebben B-cellen een centrale positie in de pathogenese van AAV omdat ze verantwoordelijk zijn voor de initiatie van de ANCA-productie. De AAV-ziekteac- tiviteit lijkt gecorreleerd te zijn met de hoeveelheid geactiveerde B-cellen. Depletie van B-cellen met anti-CD20 rituximab is een effectieve therapie bij het induceren en onderhouden van AAV-ziekteremissie. De terugkeer van B-cellen na rituximabtherapie kan een AAV-recidief voorspellen. Het is aangetoond dat na inductie van remissie met rituximab en cyclofosfamide, de terugkeer van B-cellen een terugval van AAV kan inluiden. [4] De pathogenese van middelgroteen grotevatenvasculitiden begint met een toll-like receptor (TLR)-gemedieerde dendritische celactivering in de adventitia van een bloedvat gevolgd door interferon-g-producerende T-helpercel (Th)1 en interleukine-17-producerende Th17-activatie op een momenteel nog niet nader gedefinieerd antigeen. Pathogene antistoffen zoals ANCA zijn niet geïdentificeerd en spelen waarschijnlijk geen rol bij een grotevatenvasculitis.
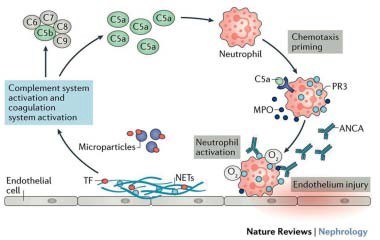
Figuur 2. ‘Priming’ van neutrofielen door cytokines, zoals C5a of TNF-a, leidt tot de translocatie van ANCA-antigenen zoals myeloperoxidase (MPO) of proteïnase-3 (PR3) van het cytoplasma naar het celoppervlak. Het binden van ANCA leidt bij deze geprimede neutrofielen tot respiratoire burst en degranulatie, en het vrijmaken van weefsel factor (TF)-houdende microdeeltjes en neutrofiele extracellulaire vallen(NETs). Dit induceert endotheelcelschade, activatie van het coagulatiesysteem en activering van de alternatieve complement ‘pathway’ via hun celmembranen, micropartikels en NETs. Op deze manier wordt C5a gegenereerd, die de lopende ontstekingsreactie verder versterkt. [10] Uit: Chen M, Jayne DRW, Zhao MH. Complement in ANCA-associated vasculitis: mechanisms and implications for management. Nature Reviews Nephrology 2017;13:359-67.
Netosis bij aav
Neutrofielen extracellulaire vallen (NET) zijn geïdentificeerd als onderdeel van het antimicrobiële wapenarsenaal van de neutrofielen. NETosis is een belangrijk instrument van de aangeboren immuniteit, in eerste instantie bedoeld om microbiële agentia sneller en doeltreffender te elimineren. NETosis is belangrijk in het veroorzaken van vasculaire schade in AAV deels via een aantal directe, zoals het induceren van apoptosis in endotheelcellen, en deels via indirecte mechanismen, zoals het initiëren van immuuncomplex- en autoantilichamenvorming. [5] NETosis is ook belangrijk bij geneesmiddelgeïnduceerde vasculitis. Aan de andere kant kan NETosis ook beschermend werken, bijvoorbeeld in het helpen om mucosale laesies bij de ziekte van Behçet te voorkomen. [6] Er zijn momenteel geen klinisch toepasbare, betrouwbare laboratoriummethodes beschikbaar om NETosis bij de AAV- patiënt adequaat te onderzoeken en monitoren.
Interleukine (il)-5 en il-6
Bij eosinofiele granulomatosis met polyangiitis (EGPA) speelt IL-5 een cruciale pathogenetische rol. IL-5 is immunologisch gezien de verantwoordelijke cytokine voor de proliferatie en de rijping in het beenmerg, het recruteren en het activeren in eindorganen van eosinofielen. Het wordt steeds duidelijker dat IL-6 een prominente plaats inneemt in de pathogenese van grotevatenvasculitis (LVV). [7] IL-6 en de oplosbare IL-6- receptor kunnen als potentiële biomarkers gebruikt worden om LVV-ziekteactiviteit adequaat te monitoren. Op therapeu- tisch gebied heeft deze kennis geleid tot de succesvolle inzet van anti-IL-5 [8] en anti-IL-6, respectievelijk bij EGPA [7] en giant cel arteriitis (GCA). TNF-a lijkt vooral een rol te spelen bij takayasu-arteriitis en de ziekte van Behçet. Het gebruik van anti-TNF-a is dan ook therapeutisch gezien alleen interessant bij deze twee aandoeningen.
Signaaltransductie
Cytokines bewerkstelligen hun cellulaire effecten allereerst via ligand-receptorinteractie en vervolgens leidt dit tot activering van een bepaalde transcriptiefactor via specifieke intracellulaire signaaltransductie-pathways. Zo lijkt de JAK/STAT-signaaltransductie-pathway bij de ziekte van Behçet en bij LVV een voorname rol te spelen. [9] Ook het intracellulair verhogen van cyclisch-AMP lijkt klinisch gunstige effecten te hebben bij de ziekte van Behçet.
Ten slotte
Het is belangrijk bij alle vormen van PSV translationeel onderzoek te blijven doen. Hierdoor zal de arts met toenemende kennis verworven op verschillende basale gebieden, variërend van (epi)genetica tot intracellulaire signaaltransductie, een PSV-patiënt kunnen behandelen met behulp van een personalized medicine-precisiestrategie. [11] Tevens kunnen meer nieuwe effectieve, veilige immune targeted-behandelingen worden ontwikkeld.
Literatuur
1. Jennette JC, Falk RJ. ANCAs are also antimonocyte cytoplasmic auto- antibodies. Clin J Am Soc Nephrol 2015;10(1):4-6.
2. Manenti L, Urban ML, Maritati F, et al. Complement blockade in ANCA-associated vasculitis: an index case, current concepts and future perspectives. Intern Emerg Med 2017;12(6):727-31.
3. Chen SF, Wang FM, Li ZY, Yu F, Chen M, Zhao MH. Myeloperoxidase influences the complement regulatory activity of complement factor H. Rheumatology (Oxford) 2018 Feb 19 [Epub ahead of print].
4. McAdoo SP, Medjeral-Thomas N, Gopaluni S, et al. Long-term follow-up of a combined rituximab and cyclophosphamide regimen in renal anti-neutrophil cytoplasm antibody-associated vasculitis. Nephrol Dial Transplant 2018. 10.1093/ndt/gfx378.
5. Kraaij T, Kamerling SWA, Van Dam LS, et al. Excessive neutrophil extracellular trap formation in ANCA-associated vasculitis is independent of ANCA. Kidney Int 2018 Mar 30 [Epub ahead of print].
6. Mohanty T, Sjögren J, Kahn F, et al. A novel mechanism for NETosis provides antimicrobial defense at the oral mucosa. Blood 2015;126(18):2128-37.
7. Pulsatelli L, Boiardi L, Assirelli E, et al. Interleukin-6 and soluble inter- leukin-6 receptor are elevated in large-vessel vasculitis: a cross-secti0nal and longitudinal study. Clin Exp Rheumatol 2017;35 (Suppl.103):S102-10.
8. Wechsler ME, Akuthota P, Jayne D, et al. Mepolizumab or placebo for eosinophilic granulomatosis with polyangiitis. N Engl J Med 2017;376:1921-32.
9. Zhang H, Watanabe R, Berry GJ, Tian L, Goronzy JJ, Weyand CM. Inhibition of JAK-STAT signaling suppresses pathogenic immune respon- ses in medium and large vessel vasculitis. Circulation 2018;137(18):1934-48.
10. Chen M, Jayne DRW, Zhao MH. Complement in ANCA-associated vasculitis: mechanisms and implications for management. Nature Reviews Nephrology 2017;13:359-67.
11. Ozen S, Batu ED. Vasculitis pathogenesis: Can we talk about precision medicine? Front Immunol 2018;9:1892. Published online 2018 Aug 14.
Samenvatting
Primaire systemische vasculitis (PSV) is een inflammatoire vasculaire aandoening die wordt geclassificeerd op basis van de grootte van het aangedane bloedvat. Er zijn verschillende onderliggende vaak immunologisch pathofysiologische mechanismen bij vasculitis betrokken waarbij het niet-specifieke aangeboren (innate) en het specifieke adaptieve immuunsysteem betrokken zijn. Er is steeds meer bekend over de genetische achtergrond van PSV. Bij ANCA- geassocieerde kleinevatenvasculitis (AAV) is de neutrofiel in staat met behulp van de neutrofiele extracellulaire vallen (NETs) samen met het complementsysteem endotheelschade te veroorzaken. Bepaalde cytokines staan op de voorgrond bij sommige PSV-vormen, bijvoorbeeld interleukine (IL)-6 bij giant cell arteriitis (GCA). Specifieke intracellulaire signaaltransductie-pathways kunnen overgeactiveerd zijn zoals de JAK/STAT-pathway bij de ziekte van Behçet en bij grotevatenvasculitis (LVV).
Trefwoorden
vasculitis – ANCA – neutrofielen – NET – complement – IL-5 – IL-6 – signaaltransductie.
Correspondentieadres
Bing Thio
E-mail: h.thio@erasmusmc.nl