Artikelen
Artikelen - Belangrijk(st)e ontwikkelingen in de klinische dermatologie (2019-03)
R. Hoekzema
Bespreken van de belangrijkste ontwikkelingen in de klinische dermatologie in een beknopt artikel of in een presentatie van dertig minuten is een onmogelijke opgave: er zijn simpelweg te veel ontwikkelingen, maar welke als ‘allerbelangrijkst’ beschouwd worden hangt bovendien af van de specifieke interesses van de lezer, respectievelijk toehoorder. Niet zelden betreft het nieuwe inzichten bij zeldzame dermatosen, wetenschappelijk van groot belang maar beduidend minder relevant voor de dagelijkse praktijkvoering. Daarom is in het navolgende gekozen voor recente studies bij twee huidaandoeningen, die wij vrijwel elke dag tegenkomen en lang niet altijd optimaal kunnen behandelen: acne en rosacea. De gepubliceerde resultaten verschaffen nieuwe inzichten in de pathofysiologie van deze twee dermatosen en bieden perspectief op nieuwe behandelopties. Om die redenen zijn ze door de auteur geselecteerd als ‘in elk geval belangrijk’.
Pathomechanistische ontwikkelingen
De exacte rol van Propionibacterium acnes (recent omgedoopt tot Cutibacterium acnes) in de pathogenese van acne vulgaris is nog steeds onduidelijk. [1] Selectief uitschakelen van P. acnes of van diens lokale effecten op de huid zou het inzicht in de bijdrage van deze bacterie aan acne kunnen vergroten. De onderzoeksgroep van Richard Gallo ontwikkelde een vaccin tegen Christie-Atkins-Munch-Petersen (CAMP)-factor, een door P. acnes uitgescheiden virulentiefactor, die cytotoxisch werkt op onder andere keratinocyten en sebocyten (door er gaten in te boren) en zo een ontstekingsreactie opwekt (figuur 1). [2] Gallo’s groep immuniseerde muizen met CAMP en onderzocht het effect van het opgewekte anti-CAMP-vaccin in-vivo in muizen en van een monoclonaal anti-CAMP-antilichaam ex-vivo in kweekbiopten van acnepatiënten. In muizen zorgde het vaccin voor remming van de ontstekingsreactie op P. acnes, geïnjecteerd in hun oren. Toevoegen van een monoclonaal an- tilichaam tegen CAMP aan humane acne explants resulteerde na 24 uur in afname van de ontstekingscytokines IL-8 en IL-1b. Misschien kan immunotherapie door vaccinatie tegen CAMP- factoren van P. acnes in de toekomst bijdragen aan de behandeling van patiënten met ernstige/hardnekkige acne.
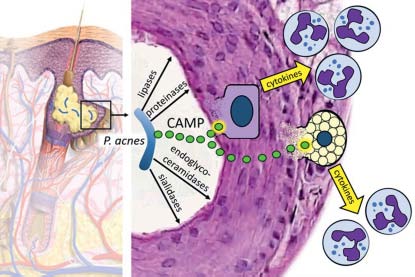
Figuur 1. ‘Propionibacterium acnes’ produceert enzymen (onder andere lipases, proteïnases, endoglycoceramidases en sialidases) en Christie-Atkins- Munch-Petersen (CAMP)-factoren, die cytotoxisch zijn voor keratinocyten en sebocyten in de haartalgklierfollikel. De beschadigde folliculaire cellen produceren pro-inflammatoire cytokinen, waaronder chemokinen, die neutrofiele granulocyten aantrekken.
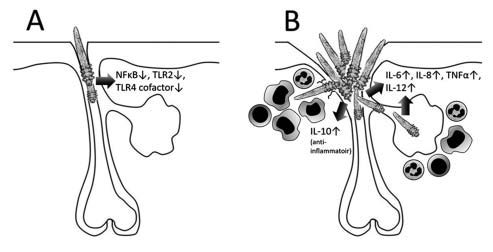
Figuur 2. Hypothetische situatie in gezonde huid (A) en bij rosacea (B). Normaliter onderdrukt ‘Demodex folliculorum’ de immuunrespons van de gastheer door remming van onder andere NF-kB, TLR2- en TLR4-cofactor. Bij rosacea induceren de grotere aantallen mijten juist pro-inflammatoire cytokinen; de chitinebekleding van in de dermis terechtgekomen mijten draagt daar aan bij door activatie van macrofagen. Anderzijds kunnen mijten (als overlevingsstrategie) de ontstekingsreactie reguleren door inductie van cytokineremmer IL-10 (adaptatie van figuur 4 uit Lacey, et al. [3]).
Een andere commensale bewoner van onze haartalgkliercom-plexen waarvan de pathogenetische betekenis al decennia wordt bediscussieerd is Demodex folliculorum bij rosacea (‘kip of ei’? pathogeen of epifenomeen?). Noreen Lacey uit de groep van rosaceaonderzoeker Frank Powell isoleerde demodexmijten van gezonde humane huid en voegde de levende mij- ten, of medium waarin ze waren bewaard toe aan een talgkliercellijn. [3] Bij lage aantallen mijten werden immuno- suppressieve effecten gevonden, waaronder remming van de transcriptiefactor nucleaire factor kappa B (NF-kB), toll-like receptor 2 (TLR2) en TLR4 cofactor (figuur 2A). Dit is te begrijpen vanuit het belang van de parasiet om in onze haartalgklierfol- likels te overleven en vooral geen afweerreactie op te wekken. Echter, bij hoge aantallen mijten (zoals het geval is bij rosacea) werden juist afweerstimulerende/pro-inflammatoire effecten gemeten, zoals inductie van IL-8 (figuur 2B). Meer onderzoek is nodig om deze ‘omslag’ van anti- naar pro-inflammatoire eigenschappen van Demodex te doorgronden. Identificatie van de betrokken ontstekingsbevorderende factoren, geproduceerd door de ‘samenscholende’ mijten kan een eerste stap zijn op weg naar een nieuwe therapie voor rosacea.
Therapeutische ontwikkelingen
Bij acne vulgaris of adultorum, die onvoldoende verbetert op lokale behandeling met benzoylperoxide en/of een retinoïde gel/crème gecombineerd met een topisch antibioticum en waarbij er nog geen indicatie (of juist een contra-indicatie) bestaat voor isotretinoïnecapsules, kiezen dermatologen doorgaans voor doxycycline of minocycline per os. Hoewel er in de literatuur aanwijzingen zijn dat oraal minocycline sterker anti-inflammatoir werkt dan doxycycline, concludeert de NVDV Richtlijn Acneïforme dermatosen dat dit bewijs onvoldoende is om de voorkeur te geven aan (het duurdere) minocy- cline. [4] Met het oog op de potentiële bijwerkingen van deze orale antibiotica en het risico op resistentieontwikkeling (ook bij andere bacteriën dan P. acnes) zou topische toepassing van een tetracyclineachtig antibioticum bij acne en rosacea aantrekkelijk zijn, mits effectief.
Recent is bij acne de effectiviteit van een topisch minocycline 4% schuim (codenaam FMX101) onderzocht in twee fase 3-klinische trials. [5] In totaal participeerden 961 patiënten in deze gerandomiseerde dubbelblinde fase 3-studies, waarbij applicatie van minocycline 4% schuim éénmaal daags gedurende 12 weken werd vergeleken met het schuimvehiculum alleen. De afname in inflammatoire papels en pustels werd bepaald, evenals het aandeel patiënten met therapeutisch succes, gede- finieerd als een Investigator’s Global Assessment (IGA)-score clear of almost clear ten opzichte van de uitgangswaarden.
Beide trials lieten zien dat minocycline 4% schuim effectiever was dan vehiculum in het reduceren van inflammatoire laesies. Een significante verbetering van de IGA werd echter slechts in één van de twee RCT’s gehaald. Een derde, bij schrijven van dit artikel nog niet gepubliceerde trial bij 1507 acnepatiën- ten toonde na 12 weken een indrukwekkende reductie van papulopustels onder invloed van minocycline 4% schuim (P < 0,0001) en een overtuigende verbetering van de IGA (P < 0,0001). FMX101 werd door de patiënten goed getolereerd en serieuze bijwerkingen werden niet gevonden (Foamix press release, 11 september 2018).
Het lag voor de hand om de effectiviteit van minocycline schuim ook bij rosacea te onderzoeken. In een multicenter RCT werden 232 patiënten met rosacea papulopustulosa 12 weken behandeld met 1,5% of 3% minocycline schuim (FMX103), of schuimvehiculum alleen. [6] De te meten eindpunten waren wederom verbetering van de inflammatoire laesies en de IGA. Beide minocyclineconcentraties resulteerden al na 2 weken in een vrijwel vergelijkbare significante verbetering van papulopustels ten opzichte van vehiculum, na 12 weken bedroeg de P-waarde P < 0,001. Ten aanzien van de IGA-verbetering deed minocycline 1,5% schuim niet onder voor de 3% concentratie en beide doseringen werden goed getolereerd.
Van belang is om te vermelden dat de hier besproken studies werden gesponsord door Foamix Pharmaceuticals, dat dit jaar streeft naar FDA-goedkeuring voor de toepassing van minocycline schuim bij rosacea (FMX103: 1,5% minocycline) en acne (FMX101: 4% minocycline). We zullen moeten afwachten wanneer minocyclineschuim in ons land beschikbaar komt.
Literatuur
- Dréno B, Pécastaings S, Corvec S, et al. Cutibacterium acnes (Propioni- bacterium acnes) and acne vulgaris: a brief look at the latest updates. J Eur Acad Dermatol Venereol 2018;32(Suppl 2):5-14.
- Wang Y, Hata TR, Tong YL, et al. The anti-inflammatory activities of Propionibacterium acnes CAMP factor-targeted acne vaccines.
- J Invest Dermatol 2018;138:2355-64.
- Lacey N, Russell-Hallinan A, Zouboulis CC, Powell FC. Demodex mites modulate sebocyte immune reaction: possible role in the pathogene- sis of rosacea. Br J Dermatol 2018;179:420-30.
- Richtlijn Acneïforme dermatosen/Acne (herformulering 2013). NVDV, 2014.
- Gold LS, Dhawan S, Weiss J, et al. A novel topical minocycline foam for the treatment of moderate-to-severe acne vulgaris: results of 2 rando- mized, double-blind, phase 3 studies. J Am Acad Dermatol 2018 [Epub ahead of print, published online october 5].
- Mrowietz U, Hetzroni Kedem T, Keynan R, et al. A phase ii, randomized, double-blind clinical study evaluating the safety, tolerability,
- and efficacy of a topical minocycline foam, fmx103, for the treatment of facial papulopustular rosacea. Am J Clin Dermatol 2018;19:427-36.
Samenvatting
In dit artikel wordt een selectie van belangrijke ontwikke lingen in de klinische dermatologie besproken, aan de hand van recente publicaties over de frequent voorkomende huidaandoeningen acne en rosacea. De artikelen van res- pectievelijk Wang et al. en Lacey et al. verschaffen nieuwe inzichten in de pathogenese van deze folliculaire dermatosen, in het bijzonder met betrekking tot de vermoede
pro-inflammatoire rol van twee commensale bewoners van onze haartalgklierfollikels: de bacterie Propionibacterium acnes (recent omgedoopt tot Cutibacterium acnes) bij acne en de mijt Demodex folliculorum bij rosacea. De andere twee studies, van Gold et al. en Mrowietz et al., beschrijven een veelbelovende nieuwe topische toepassing van mino- cycline bij acne en rosacea: minocycline schuim. Op grond van de effectiviteit en het gunstige bijwerkingenprofiel verwacht de fabrikant dat minocycline schuim binnenkort door de FDA wordt goedgekeurd als nieuwe lokale behandeloptie bij acne en papulopustuleuze rosacea. We zullen moeten afwachten wanneer het voor onze patiënten beschikbaar komt.
Trefwoorden
acne – rosacea – Propionibacterium acnes – Demodex folliculorum – minocycline
Correspondentieadres
Rick Hoekzema
E-mail: r.hoekzema@amc.uva.nl, r.hoekzema@vumc.nl