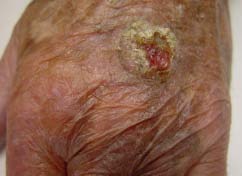
Artikelen
Richtlijnen - Samenvatting Richtlijn plaveiselcelcarcinoom van de huid 2018 (2019-01)
M.F. Hofhuis, L. Teligui, G.A.M. Krekels
De oorspronkelijke multidisciplinaire Richtlijn plaveiselcelcarcinoom van de huid dateert uit 2010 en is in 2018 modulair herzien. De belangrijkste wijziging uit de modulaire herziening betreft de TNM-classificatie naar aanleiding van internationale American Joint Committee on Cancer (AJCC) 8 eind 2016. Daarnaast geven we een update van de diagnostiek, therapie en follow-up van patiënten met een plaveiselcelcarcinoom (PCC) van de huid.
Classificatie
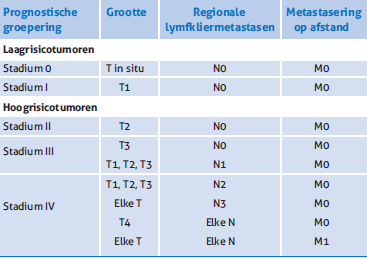
In de vorige versie van deze richtlijn (2010) werd nog de zevende editie van de TNM-classificatie geadviseerd van de AJCC (AJCC 7). [1] De achtste editie van de TNM-classificatie (AJCC 8) is per januari 2017 ingevoerd voor de klinische prak- tijk en een jaar later als classificatiesysteem voor tumorregi- straties aangehouden. [2] AJCC 8 (zie tabel 1) geeft de prognose en het beloop van het cutaan PCC in het hoofd-halsgebied goed weer. De richtlijnwerkgroep is van mening dat deze indeling ook in de Nederlandse praktijk moet worden gebruikt voor de stadiëring van laag- of hoogrisico-PCC’s van de huid in zowel het hoofd-halsgebied (inclusief peri-oculaire tumoren en het lippenrood) als daarbuiten.
PCC’s TNM-stadium II of hoger moeten beschouwd worden als hoogrisicotumoren (zie tabel 2). Een groot voordeel is dat de TNM-classificatie een stuk eenvoudiger is geworden.
Een nadeel is dat enkele bekende risicofactoren buiten beschouwing zijn gelaten.
Hoewel risicofactoren zoals differentiatiegraad, angio-invasie, lokalisatie en recidief tumoren minder onafhankelijk bijdragen aan het risico op metastasering volgens de AJCC 8-criteria, acht de werkgroep het wel belangrijk deze factoren in het OK-verslag en het pathologieverslag op te nemen om eventuele toekomstige wijzigingen in het classificatiesysteem opnieuw te kunnen beoordelen. De werkgroep adviseert om een dieptegroei van > 6 mm aan te houden als risicofactor voor metastasering (conform AJCC 8). [3] Aanbevolen wordt de invasiediepte te meten vanaf de aangrenzende intacte huid tot aan de tumorbodem. De immuunstatus wordt ook in de nieuwste TNM-classificering niet meegenomen. Het is evenwel sterk aan te bevelen bij de individuele patiënt hier aandacht aan te besteden.
De grootste wijziging in de AJCC 8 is de overgang in classifi- catie van een pT3-stadium bij diepe invasie voorbij het subcu- tane vet of > 6 mm. Perineurale invasie wordt gedefinieerd als betrokkenheid van de zenuwschede van een zenuw die dieper ligt dan de dermis of > 0,1 mm in omvang, of die klinische of radiografische betrokkenheid van zenuwen vertoont zonder invasie in de schedelbasis.
Diagnostiek
Lichamelijk onderzoek
Vanwege het belang als prognostische factoren, moeten de locatie en de grootte (inclusief induratie) van de afwijking genoteerd worden. Bij palpatie wordt gelet op de verhouding tot de onderlaag om te beoordelen of sprake kan zijn van groei in de dieper gelegen structuren, zoals spier en bot. Bij een af- wijking die klinisch verdacht is voor een PCC is onderzoek van de regionale lymfklierstations vereist. Inspectie van de gehele huid is aangewezen. Daarbij heeft men aandacht voor andere huidafwijkingen passend bij zonlichtschade en huidtype.
Biopt
Bij klinische verdenking wordt histologisch onderzoek verricht, middels een biopt of excisie van adequate diepte (minimaal subcutaan). Een shave biopt geeft geen beoordeling van de diepte van de invasieve ingroei noch van perineurale of angio-invasieve groei.
Tabel 1. TNM-classificatie (AJCC 8e editie).

* Diepe invasie = invasie voorbij het subcutane vet of > 6 mm. Perineurale invasie wordt gedefinieerd als betrokkenheid van de zenuwschede van een zenuw die dieper ligt dan de dermis of > 0,1 mm in omvang, of die klinische of radiografische betrokkenheid van zenuwen vertoont zonder invasie in de schedelbasis.
** Klinisch extranodale extensie = de aanwezigheid van huidbetrokkenheid of invasie van weke delen met diepe fixatie aan onderliggende spier of omliggende structuren of klinische tekenen van zenuwbetrokkenheid.
Aanvullende diagnostiek
In de herziening van 2018 is deze paragraaf uitgebreid met betrekking tot beeldvormende diagnostiek bij hoogrisicotu- moren bij niet-immuungecompromitteerde patiënten.
Het PCC verspreidt zich bij voorkeur naar lokale lymfklieren, meestal gedurende het eerste jaar na vaststellen van de primaire tumor. De kans op metastasering naar locoregionale lymfklieren is < 5% voor laagrisicotumoren en 10-20% voor hoogrisicotumoren. In het algemeen is beeldvormende diagnostiek niet aangewezen bij laagrisicotumoren en altijd aangewezen bij hoogrisicotumoren. Vanwege het ontbreken van bewijs over de prognostische waarde van het routinema- tig verrichten van beeldvorming bij primaire PCC’s van de huid ter detectie van regionale metastasen kan daar geen aanbeve- ling over worden gedaan. Bij verdenking op ossale betrokken- heid c.q. infiltratie in diepere weke delen of perineurale uitbreiding van de primaire tumor kan een CT of MRI worden overwogen. Bij regionale lymfadenopathie en/of klinische palpabele klieren wordt een echo met eventueel een punctie geadviseerd. Een PET-CT kan worden overwogen bij klinische verdenking op afstandsmetastasen of voor het beoordelen van respons na radiotherapie. Overweeg een verwijzing naar een Hoofd-hals Oncologisch Centrum bij grote, recidief en hoog- risicotumoren in het hoofd-halsgebied.
Tabel 2. Prognostische groepering.
Therapie
Algemeen
In deze richtlijnherziening zijn er behoudens de toevoeging van de Breuninger-methode naast de mohschirurgie geen wijzigingen in therapiekeuze. Het is wel goed zich te realiseren dat er naar aanleiding van de introductie van de AJCC 8, wijzi- gingen zijn in classificatie tussen laag- en hoogrisicotumoren waarmee de toepassing van therapiekeuze in sommige situa- ties verschoven is.
Het doel van behandeling is complete (bij voorkeur histologisch bevestigde) verwijdering of destructie van de primaire tumor en eventuele metastasen. Het is wenselijk de kwaliteit van leven bij de behandeling van een PCC te betrekken en mee telaten wegen bij behandelbeslissingen. Grote, hoogrisicotumo- ren en recidiverende tumoren worden bij voorkeur in een multidisciplinair overleg besproken. De uitkomst daarvan wordt vastgelegd in een MDO-verslag.
Een PET-CT kan worden overwogen bij klinische verdenking op afstandsmetastasen of voor het beoordelen van respons na radiotherapie.
Conventionele chirurgische excisie
Chirurgische excisie is de voorkeursbehandeling voor de meerderheid van de PCC’s van de huid. Het staat volledige karakterisatie van de tumor toe en het geeft de mogelijkheid tot het toetsen van de behandeling door histologisch onderzoek van de snijranden van het geëxcideerde preparaat. [4,5]
Klinische marge
Voor primaire, laagrisicotumoren, zoals stadium I-tumoren, wordt een klinische marge van 5 mm rondom de tumor aanbevolen. Hierbij is de primaire tumor in meer dan 95% van de gevallen compleet verwijderd. Voor hoogrisicotumoren (TNM-stadium II of hoger) en recidief tumoren wordt een klinische marge van 1 cm rondom de tumor aanbevolen.
Histologische marge
In retrospectieve studies naar gemetastaseerde PCC’s van de huid en de lip wordt bij een histologische marge kleiner dan 2 mm een grotere kans gevonden op metastases en recidieven.
[6] Bij een histologische marge van minder dan 2 mm wordt een re-excisie aanbevolen bij hoogrisico (vanaf stadium II) PCC’s. [7]
Sluiting
Het is aan te bevelen een defect na radicale excisie pas chirurgisch te sluiten na histopathologische bevestiging. Kleine tumoren kunnen primair worden gesloten. Bij afwezig- heid van histologisch bevestigde radicaliteit of een actinische beschadigde huid, is het niet wenselijk om wondsluiting te verkrijgen met een huidtranspositie. Bij verschuiving van huid is immers niet meer te achterhalen waar het irradicale deel is en de reconstructie zal veelal opgeofferd moeten worden bij een re-excisie.
OK-verslag
Als excisie heeft plaatsgevonden is een OK-verslag met daarin de prognostische factoren wenselijk, om correcte stadiëring van de tumor mogelijk te maken. Dit OK-verslag bevat ten minste de volgende items:
- gehanteerde excisiemarge en niveau van excisie (subcutis, fascie)
- lokalisatie van de excisie
- wijze van sluiting
- wijze van markering
Radiotherapie
Er zijn aanwijzingen dat radiotherapie alleen, bij PCC gene- zingskansen biedt die vergelijkbaar is met andere behandelin- gen. Radiotherapie zal in bepaalde omstandigheden het beste cosmetische en/of functionele resultaat geven. In gevallen waar er discussie bestaat over of radiotherapie of chirurgie de beste optie is, moeten er nauwe banden bestaan tussen een dermatoloog, radiotherapeut en (plastisch) chirurg; idealiter in een multidisciplinair overleg. Dit geldt voornamelijk voor stadium II-tumoren met als toevoeging de tumoren op het vestibulum nasi, de ala nasi en de neuspunt. Sommige locaties hebben echter een lage tolerantie voor radiotherapie, bijvoorbeeld de handrug en het onderbeen en chirurgische excisie heeft op deze plaatsen de voorkeur. In gevallen waar radio- therapeutisch behandeld wordt, biedt de richtlijn houvast.
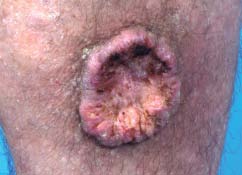
Micrografische chirurgie
Micrografische chirurgie, waaronder Mohs micrografische chirurgie (MMC) en de Breuninger-methode, maakt het moge- lijk om de per continuitatem groeiende primaire tumor met grote nauwkeurigheid te lokaliseren en te excideren. Behande- ling middels chirurgie volgens Breuninger wordt verricht bij grote PCC’s in het hoofd-halsgebied. Micrografische chirurgie (Mohs of Breuninger) voor de behandeling van het PCC kan overwogen worden bij T1- en T2-tumoren op locaties waar weefselsparend werken gewenst is, i.e. in het gelaat en bij eri-/intraneurale groei van de tumor.
Cryochirurgie
Cryochirurgie kan men enkel bij zeer kleine en laagrisicotu- moren overwegen en uitsluitend door clinici met ervaring in cryochirurgie worden toegepast. Gezien de mogelijkheid van radicaliteitscontrole verdient chirurgische excisie ook voor kleine tumoren de voorkeur boven cryochirurgie.
Curettage en coagulatie
Gezien de mogelijkheid van radicaliteitscontrole verdient chirurgische excisie ook voor kleine tumoren (< 10 mm) de voorkeur boven curettage en coagulatie.
Andere therapieën
Topicaal imiquimod, intralaesionaal interferon alfa, intralaesi- onaal/ lokaal 5-fluorouracil en topicale fotodynamische thera- pie zijn gecontra-indiceerd bij de behandeling van het plaveiselcelcarcinoom.
Therapie bij locoregionale metastasen
In geval van één of meerdere lymfekliermetastasen is chirur- gische dissectie van het betreffende lymfekliergebied sterk aan te bevelen. In geval van tumoren (grote T2, T3 of T4) met negatieve histologische groeikenmerken, meerdere lymfklier- metastasen en/of lymfkliermetastasen met extracapsulaire groei wordt adjuvante radiotherapie overwogen. De positie van lymfklierbiopsie van de poortwachterklier is bij het PCC van de huid nog onduidelijk en wordt door de werkgroep momenteel afgeraden indien dit niet in trialverband plaatsvindt bij een selecte groep PCC’s.
Transplantatie/immuungecompromiteerde patiënten
Chronische immunosuppressie gaat gepaard met een verhoogd risico op non-melanoma skin cancer (NMSC), met name PCC’s. Het risico op posttransplantatie NMSC hangt samen met type, duur en intensiteit van immunosuppressie en is het hoogst in een zonnig klimaat, bij NMSC in de voorgeschiedenis, een oudere leeftijd (> 50 jaar), blanke huid, mannelijk geslacht en na long- of harttransplantatie. Bij orgaantransplantatiepatiën- ten met multipele NMSC kan het zinvol zijn om de immuno- suppressieve therapie aan te passen naar mammalian target of rapamycin (mTOR)-inhibitors (sirolimus, everolimus). Dit kan het risico op huidtumoren (licht) verlagen.[8] Het omzet- ten van medicatie vindt op individuele basis plaats, in nauw overleg tussen orgaanspecialist en dermatoloog. Vanwege het verhoogde risico op NMSC bij chronische immunosuppressie wordt het aanbevolen patiënten voorafgaand aan of bij voorkeur binnen één jaar tijd na een orgaantransplantatie te verwijzen naar een dermatoloog voor huidkankerpreventiead- viezen. Het verdient aanbeveling om transplantatiepatiënten met premaligniteiten en één NMSC in de voorgeschiedenis 2x per jaar te laten controleren door de dermatoloog en transplantatiepatiënten met meerdere NMSCs in de voor- geschiedenis 4x per jaar. Afhankelijk van aanwezige risico- factoren kan voor de individuele patiënt een andere follow- upfrequentie wenselijk zijn. Bij orgaantransplantatiepatiënten met een PCC is de profylactische behandeling met retinoïden een optie.
Follow-up
Het doel van een controle na behandeling van de patiënt met een cutaan PCC is vroege detectie en behandeling van lokale en regionale recidieven ten einde de overleving van deze patiënten te verbeteren. Er zijn aanwijzingen dat 75% van de lokale recidieven en metastasen binnen twee jaar wordt ont- dekt en 95% binnen vijf jaar. [4,5,9] Het is belangrijk de patiënt zelf, indien mogelijk, actief bij de follow-up te betrekken door zelfonderzoek van het litteken, de omgevende huid en de lymfklieren. Patiënten dienen informatie te krijgen met heldere instructies wat te doen als ze een recidief vermoeden. De controle naar recidieven wordt verricht door de dermato- loog, bij multidisciplinaire behandeling alternerend met andere behandelaars bij voorkeur volgens onderstaand follow-upschema (figuur 1). De controle bestaat uit inspectie en palpatie van het behandelde gebied en de regionale lymfklierstations, evenals inspectie van de gehele huid. Laboratoriumonderzoek en beeldvormend onderzoek worden alleen op indicatie verricht.

Figuur 1. Aanbevolen follow-upschema’s.
Voorlichting
Patiënten met een PCC moeten worden voorgelicht over UV- protectie. Het meegeven en/of toegang verschaffen tot patiënteninformatie is noodzakelijk, in de vorm van een folder of websites. Naast de behandelend specialist kan een gespecialiseerde verpleegkundige, verpleegkundig specialist of een physician assistant een rol spelen bij de voorlichting en begeleiding van mensen met een PCC. Het verdient aanbeveling in de status te vermelden wie de voorlichting heeft gegeven en welke behandelingsmogelijkheden zijn voorgesteld.
Literatuur
- Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol 2010;17(6):1471-4.
- Amin MB, Edge S, Greene F, et al. AJCC cancer staging Manual 8th edition. New York: Springer international, 2016.
- Brantsch KD, Meisner C, Schönfisch B, et al. Analysis of risk factors determining prognosis of cutaneous squamous-cell carcinoma:
- a prospective study. Lancet Oncol 2008; 9:713-20.
- Breuninger H. Diagnostic and therapeutic standards in interdiscipli- nary dermatologic oncology.German Cancer Society, 1998.
- Rowe DE, Carroll RJ, Day CL. Prognostic factors for local recurrence, metastasis and survival rates in squamous cell carcinoma of the skin, ear and lip. J Am Acad Dermatol 1992;26:976-90.
- Quaedvlieg PJ, Creytens DH, Epping GG, et al. Histopathological characteristics of metastasizing squamous cell carcinoma of the skin and lips. Histopathology 2006;49:256-64.
- Babington S, Veness MJ, Cakir B, Gebski VJ, Morgan GJ. Squamous cell carcinoma of the lip: is there a role for adjuvant radiotherapy in improving local control following incomplete or inadequate excision? ANZ J Surg 2003;73:621-5.
- Knoll GA, Kokolo MB, Mallick R, et al. Effect of sirolimus on malig- nancy and survival after kidney transplantation: systematic review and meta-analysis of individual patient data. Br Med J 2014;349:g6679. doi: 10.1136/bmj.g6679
- Alam M, Ratner D. Cutaneous squamous-cell carcinoma. N Engl J Med 2001;344:975-83.
- Motley RJ, Preston PW, Lawrence CM. Multi-professional guidelines for the management of the patient with primary cutaneous squamous cell carcinoma 2009- update of the original guideline which appeared in Brit J Dermatol 2002;146:18-25.
Correspondentieadres
Mijke Hofhuis
E-mail: m.hofhuis@nvdv.nl