Artikelen
What's new in pharmacy - Certolizumab pegol- Cimzia (2019-02)
W.R. Veldkamp, M.B.A. van Doorn
Certolizumab pegol (CZP) is een recombinant, gehumaniseerd antilichaam Fab’ fragment dat is gericht tegen tumornecrosefactor-alfa (TNF-a). CZP wordt al langere tijd toegepast bij de behandeling van reumatoïde artritis, axiale spondylartritis en artritis psoriatica, maar is pas recent geregistreerd voor de behandeling van matig tot ernstige plaque psoriasis.
Werkingsmechanisme
CZP is een TNF-a-remmer die wordt geproduceerd door Escherichia coli. [1] CZP bindt aan circulerend en membraan gebonden TNF-a via het Fab’ (antigeenbindende) gedeelte van het molecuul. TNF-a is een belangrijk cytokine in de pathofysiologie van psoriasis; remming hiervan leidt uiteindelijk tot vermindering van de inflammatie en verbetering van de klinische symptomen (figuur 1). De reeds bekende TNF-a-remmers zijn opgebouwd uit een Fc-staart en twee Fab’-armen van het immuunglobuline (adalimumab en infliximab) of een Fc-staart gefuseerd met een TNF-a-receptor (etanercept). CZP heeft daarentegen geen Fc-staart en is opgebouwd uit een enkel Fab’-gedeelte gekoppeld aan een polyethyleenglycol (PEG) molecuul (figuur 2). Doordat CZP de Fc-staart mist, geeft het in vitro geen antilichaamafhankelijke cellulaire en complementgemedieerde cytotoxiciteit. [2] Bovendien zorgt de afwezigheid van de Fc-staart ervoor dat CPZ niet kan binden aan de neonatale Fc-receptor. [3] Deze receptor is onder andere betrokken bij het actief trans- placentair transport van IgG van moeder naar kind vanaf het tweede trimester. [4] Door Mariette et al. is in een kleine popu- latie (n=16) aangetoond dat er vrijwel geen transplacentair transport van CPZ naar de neonaat plaatsvindt. [5] Ook werden in deze studie geen congenitale afwijkingen gevonden.
Effectiviteit
In een drietal klinische fase 3-studies is gekeken naar de effectiviteit van CZP bij matig tot ernstige plaque psoriasis (CIMPASI-1, CIMPASI-2 en CIMPACT). Alle studies includeerden patiënten met een PASI > 12, een BSA > 10% en een physician global assessment (PGA)-score > 3. Daarnaast mochten de patiënten niet eerder zijn behandeld met meer dan twee biologics, primair (binnen twaalf weken) gefaald hebben op een biologic, of secundair gefaald hebben op meer dan één biologic. De CIMPASI-studies hadden een dubbelblinde gerandomiseerde opzet en vergeleken CZP met placebo. De CIMPACT-studie had een gerandomiseerde, grotendeels dubbelblinde opzet, met als controles zowel placebo als etanercept.
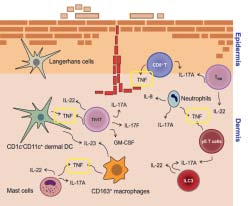
Figuur 1. Vereenvoudigde immunologie in een psoriasis plaque. Karakteristieke markers en cytokinen van T-cellen, dendritische cellen (DCs) en andere immuuncellen in psoriasis plaques. Aangepast van Eberle et al. 2016. [12]
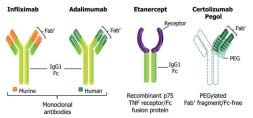
Figuur 2. Moleculaire structuur TNF-a-remmers. De moleculaire structuur van de voor psoriasis vulgaris beschikbare TNF-a remmers. Aangepast van Weir et al. 2006. [13]
De CIMPASI-studies toonden gepooled 76,7% PASI 75, 45,9% PASI 90 en 56,8% PGA0/1 responders na 16 weken op certolizumab 200 mg/2 weken. Bij 400 mg/2 weken waren deze per- centages 82,0% PASI 75, 52,2% PASI 90 en 65,3% PGA0/1. Deze klinische respons was voor alle uitkomstmaten statistisch significant in vergelijking met placebo. [6] In een eerdere fase 2-studie werden vrijwel dezelfde resultaten gerapporteerd. [7] Na 48 weken was er sprake van een PASI 75 bij 70,7% van de patiënten op 200 mg/2 weken en bij 83,6% van de patiënten op 400 mg/2 weken. De PGA0/1 werd respectievelijk gehaald in 61,0% en 68,9% van de patiënten. Opmerkelijk was hierbij dat de patiënten in de eerste studie minder positieve resulta- ten toonden dan de patiënten in de tweede studie met dezelfde opzet. [6]
De CIMPACT-studie toonde iets lagere getallen op week 16, namelijk 68,2% PASI 75, 39,8% PASI 90 en 48,3% PGA0/1 responders na 16 weken CZP 200 mg/2 weken. Bij 400 mg/2 weken waren deze percentages 76,3% PASI 75, 72,3% PASI 90 en 40,7% PGA0/1. Deze klinische respons was statistisch significant ten opzichte van placebo. Na 12 weken is er tevens een vergelijking gemaakt met etanercept 50 mg 2x per week ten aanzien van PASI 75-scores; CZP 200 mg/2 weken is non inferieur aan etaner- cept en CZP 400 mg/2 weken lijkt superieur aan etanercept. [8] Lebwohl et al. hebben na week 16 tevens een groep van 44 patiënten met behaalde PASI 75-respons van 200 mg/2 weken naar 400 mg/4 weken laten overstappen. Na 48 weken behaalde 88,6% van deze groep nog een PASI 75 ten opzichte van 79,5% die op 200 mg/2 weken bleef staan. Ook de PGA0/1 van de 400 mg/4 weken-groep was na 48 weken hoger dan die van de 200 mg/2 weken-groep (respectievelijk 70,5% vs 61,4%), en hetzelfde gold voor de PASI 90 na 48 weken (respectievelijk 68,2% vs 61,4%).
Dosering op lichaamsgewicht
De klaring van CZP neemt af naarmate het lichaamsgewicht afneemt; hetgeen een hogere systemische blootstelling oplevert bij een lager gewicht. [1] Op basis van een post-hoc analyse lijkt stratificatie op basis van gewicht (> 90 kg of > 90 kg) mogelijk zinnig; patiënten met een laag lichaamsgewicht in combinatie met lage ziekteactiviteit zullen met 200 mg/2 weken naar alle waarschijnlijk voldoende effect bereiken. [9]
Effect op nagelafwijkingen
In een studie die zich primair heeft gefocust op het effect van CZP bij artritis psoriatica, werd tevens gekeken naar de invloed van het middel op psoriatiforme nagelafwijkingen (73,3% had baseline nagelafwijkingen). De Modified Nail Psoriasis Severity Index (mNAPSI)-verandering na 24 weken was -1,6 bij patiënten met een CZP 200 mg/2 weken (baseline 3,1 ± 1,8) en -2,0 met CZP 400 mg/4 weken (baseline 3,4 ± 2,2) ten opzichte van -1,1 in de placebogroep (baseline 3,4 ± 2,2) (p = 0,003 en p < 0,001, respectievelijk). [10]
Veiligheid
Het bijwerkingenprofiel van etanercept of placebo lijkt bij CZP niet veel te verschillen; het percentage patiënten dat bijwerkingen ervaart is namelijk 46,4% in de etanerceptgroep versus 47,3% (200 mg/2 weken) en 49,1% (400 mg/2 weken) in de CZP-groep, en 56,1% in de placebogroep na 12 weken behandeling. [8] De CIMPASI-trials ondersteunen deze getallen. [6] De meest frequent gerapporteerde bijwerkingen waren bij zowel etaner- cept als CZP nasofaryngitis en bovensteluchtweginfecties. [6,8]
Immunogeniciteit
In de bovengenoemde fase 3-studies had na 48 weken 8,3% (22/265) en 19,2% (54/281) van de patiënten op respectievelijk CZP 400 mg/2 weken en 200 mg/2 weken specifieke antistoffen. In de CIMPASI-1- en CIMPASI-2-studie waren 60 patiënten antilichaampositief, waarvan 27 werden hertest op neutraliserende antilichamen, die bij alle geteste monsters aanwezig waren. Antistoffen tegen CZP waren geassocieerd met een lagere plasmaconcentratie van CZP en in sommige gevallen ook verminderde effectiviteit. [1, niet genoemd in studies zelf]
Ervaringen uit de praktijk
Gezien de recente registratie van CZP is er in Nederland onder dermatologen nog relatief weinig ervaring met dit middel. De aanbevolen startdosis is 400 mg (2 subcutane injecties van ieder 200 mg) in week 0, 2 en 4, waarna 200 mg/2 weken als onderhoudsdosering. Een dosering van 400 mg om de 2 weken kan (tijdelijk) worden overwogen bij patiënten die onvoldoende reageren. [1] Door reumatologen wordt CZP al langere tijd voorgeschreven. Een groep reumatologen heeft in 2017 een kleine daily practice- studie verricht naar het effect op psoriasis bij patiënten met artritis psoriatica. In een groep van 32 patiënten waren er geen duidelijk geneesmiddelgerelateerde bijwerkingen en ook bij de relatief lage uitgangs-PASI (4,4 ± 4,7 en 5,1 ± 5,7 bij respectievelijk de groep die ten minste 12 weken (n = 32) en de groep die 24 weken (n = 12) werd behandeld was er een evidente daling in PASI-score (respectievelijk naar 2,3 ± 3,7 na 12 weken, en 0,8 ± 1,2 na 24 weken). [11]
Plaatsbepaling
De kortetermijneffectiviteit van CZP is vergelijkbaar met die van etanercept, waarbij CZP 400 mg/2 weken iets effectiever lijkt. Er zijn geen direct vergelijkende studies met de andere TNF-a-remmers of andere biologics verricht. CZP is reeds geregistreerd voor artritis psoriatica, zodat bij psoriasispatiënten met artritis psoriatica ook verbetering van de gewrichtsklachten kan worden verwacht. Ook kan behandeling met CZP leiden tot verbetering van psoriatiforme nagelafwijkingen. Zoals gezegd zijn er geen directe vergelijkende studies met de twee andere TNF-a-remmers, adalimumab en infliximab verricht. Op basis van onderstaande keuzematrix (tabel 1) valt echter op dat er voor beide middelen wel acceptabele langetermijn(veiligheids)data in psoriasis beschikbaar zijn en dat de toedieningsfrequentie en effectiviteit niet ongunstiger zijn dan die van CZP. Er zijn nog geen gegevens beschikbaar met betrekking tot de drug survival van CZP in plaque psoriasis. Tot slot lijkt dit middel in het bijzonder geschikt voor vrouwen met een actieve zwangerschapswens, dan wel als behandeling tijdens een bestaande zwangerschap gezien het vrijwel afwezige transplacentaire transport naar de foetus.
Samenvattend is CZP qua effectiviteit en veiligheid vergelijkbaar met de reeds beschikbare TNF-a-remmers voor psoriasis vulgaris, met de kanttekening dat er voor deze indicatie nog geen langetermijn(veiligheids)data beschikbaar zijn. Het lijkt een geschikte behandeling voor vrouwelijke psoriasispatiënten met een actieve zwangerschapswens of bestaande zwangerschap die in aanmerking komen voor behandeling met een biologic.
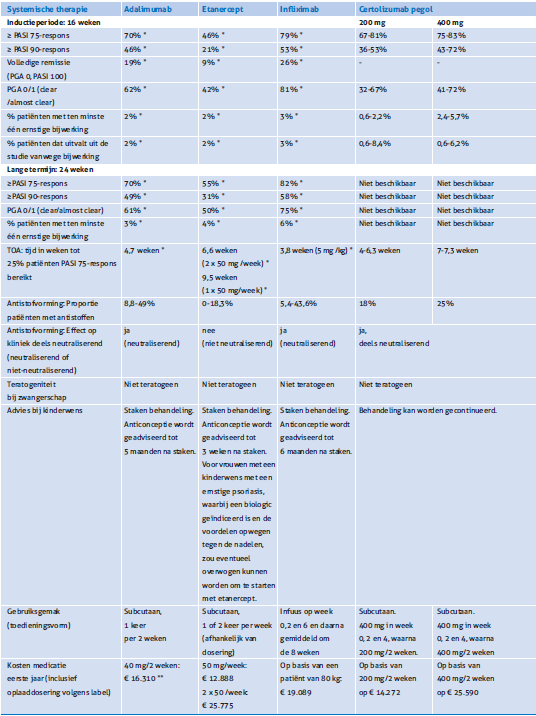
Tabel 1. Verkorte keuzematrix TNF-a-remmers (naar Richtlijn Psoriasis 2017 NVDV). [14]
* Berekend op basis van GRADE-systematiek. ** Recent is de prijs sterk verlaagd.
Literatuur
1. SmPC Cimzia. Summary of product characteristics. Brussels: UCB Pharma S.A., September 2018; Available from: https://www.ema.eu ropa.eu/documents/product-information/cimzia-epar-product-infor mation_nl.pdf
2. Nesbitt A, Fossati G, Bergin M, et al. Mechanism of action of certolizumab pegol (CDP870): in vitro comparison with other anti-tumor necrosis factor alpha agents. Inflamm Bowel Dis 2007;13:1323-32.
3. Porter C, Armstrong-Fisher S, Kopotsha T, et al. Certolizumab pegol does not bind the neonatal Fc receptor (FcRn): Consequences for FcRn-mediated in vitro transcytosis and ex vivo human placental transfer. J Repr Immunol 2016;116:7-12.
4. Simister N. Placental transport of immunoglobulin G. Vaccine 2003;21:3365-9.
5. Mariette X, Förger F, Abraham B, et al. Lack of placental transfer of certolizumab pegol during pregnancy: results from CRIB, a prospective, postmarketing, pharmacokinetic study. Ann Rheum Dis 2017;77(2):228-33.
6. Gotllieb AB, Blauvelt A, Thaçi D, et al. Certolizumab pegol for the treatment of chronic plaque psoriasis: Results through 48 weeks from 2 phase 3, multicenter, randomized, double-blinded, placebo-controlled studies (CIMPASI-1 and CIMPASI-2). JAAD. 2018;79(2):302-14.
7. Reich K, Ortonne JP, Gottlieb AB, et al. Successful treatment of moderate to severe plaque psoriasis with the PEGylated Fab‘ certolizumab pegol: results of a phase II randomized, placebo-controlled trial with a re-treatment extension. Br J Dermatol 2012;167:180-90.
8. Lebwohl M, Blauvelt A, Paul C, et al. Certolizumab pegol for the treatment of chronic plaque psoriasis: Results through 48 weeks of a phase 3, multicenter, randomized, double-blind, etanercept- and placebocontrolled studie (CIMPACT). JAAD. 2018;79(2);266-76.
9. CIMZIA® [prescribing information], Smyrna, GA: UCB Inc., 2018.
10. Mease JP, Fleischmann R, Deodhar AA, et al. Effect of certolizumab pegol on signs and symptoms in patients with psoriatic arthritis: 24-week results of a Phase 3 double-blind randomized placebo- controlled study (RAPID-PsA). Ann Rheum Dis 2014;73(1):48-55.
11. Dattola A, Cannizzaro MV, Mazzeo et al. Certolizumab pegol in the treatment of psoriasis and psoriatic arthritis: preliminary real-life data. Dermatol Ther (Heidelb) 2017;7(4):485-92.
12. Eberle FC, Brück J, Holstein J, et al. Recent advances in understanding psoriasis [version 1; referees: 2 approved]. F1000Research. 2016;5(F1000 Faculty Rev):770.
13. Weir N, Athwal D, Brown D, et al. A new generation of high-affinity humanized PEGylated Fab’ fragment anti-tumor necrosis factor(alpha) monoclonal antibodies. Therapy 2006;3:535-45.
14. Multidisciplinaire evidencebased richtlijn Psoriasis 2017 (NVDV).
Samenvatting
Certolizumab pegol (CZP) is een tumornecrosefactor-alfa (TNF-α)-remmer die recent werd geregistreerd voor de behandeling van matig tot ernstige plaque psoriasis bij volwassenen. De moleculaire opbouw van CZP verschilt van de andere TNF-α-remmers waarbij het Fc-gedeelte, onder andere belangrijk voor het transplacentaire transport van immunoglobulinen (en hierop gebaseerde biologics) ontbreekt. Deze eigenschap maakt CZP een belangrijke toevoeging aan het huidige behandelarsenaal, met name voor de vrouwelijke patiënten met actieve zwangerschap (wens), daar het de placenta vrijwel niet kan passeren en dus niet in de foetale circulatie terecht zal komen.
Summary
Certolizumab pegol (CZP) is a tumor necrosis factor-alpha (TNF-a)-inhibitor recently registered for the treatment of moderate to severe plaque psoriasis in adults. The molecular structure of CZP differs from that of other TNF-a-inhibitors because the Fc- fragment is missing, which, among other things is important for the transplacental transport of immunoglobulins (and the basis for these biologics). This quality makes CZP an important addition to the current treatment arsenal, especially for pregnant female patients (or a pregnancy wish) as it hardly passes through the placenta and will therefore not enter the fetal circulation.
Trefwoorden
certolizumab pegol – biologics – psoriasis – TNF-alfa remmer - zwangerschap
Keywords
certolizumab pegol – biologics – psoriasis – TNF-alpha inhibitor - pregnancy
Correspondentieadres
Martijn van Doorn
E-mail: m.b.a.vandoorn@erasmusmc.nl