Standpunten
Upadacitinib (standpunt)
Datum vaststelling: 12 oktober 2021
Datum publicatie NTvDV: nummer 1 2022
Domeingroep: Domeingroep Allergie en Eczeem, mede namens de domeingroep Kinderdermatologie en de VMCE
Contactadres: secretariaat@nvdv.nl
Standpunt voorschrijven upadacitinib bij volwassen patiënten en adolescenten vanaf 12 jaar met matig tot ernstig constitutioneel eczeem
Achtergrond
Janus kinase (JAK) remmers vormen een nieuwe klasse van zogenaamde ‘small molecules’ die aangrijpen op verschillende cytokine cascades, die betrokken zijn bij diverse inflammatoire aandoeningen. De JAK familie bestaat uit vier enzymen; JAK1, JAK2, JAK3 en Tyrosine kinase (TYK)2. Remming van één of meer van deze enzymen leidt tot remming van de JAK- en activator van transcriptie (STAT)-signaleringsroute. Verschillende cytokines die een belangrijke rol spelen bij de pathofysiologie van constitutioneel eczeem (CE), zoals interleukine (IL)-4, IL-13, IL-31, IL-22, thymisch stromaal lymfopoëtine (TSLP) en interferon-γ (IFN-γ) maken gebruik van de JAK1 signaleringsroute.
Upadacitinib is een selectieve en reversibele JAK-remmer van voornamelijk JAK1, en in mindere mate JAK2 en JAK3, waardoor de fosforylering en activering van STAT’s verminderd wordt.
Samenvatting van effectiviteitsdata van upadacitinib behandeling
De effectiviteit en veiligheid van upadacitinib is onderzocht in twee identieke gerandomiseerde, dubbelblinde placebogecontroleerde fase 3 studies, MEASURE-UP 1 en MEASURE-UP 2. Patiënten van 12 jaar en ouder met matig tot ernstig CE werden behandeld met upadacitinib 15 mg, 30 mg of placebo (1:1:1) één keer daags gedurende 16 weken. [1] Een significant grotere proportie patiënten behaalden het primaire eindpunt EASI75 bij 16 weken in de upadacitinib groepen 15 mg en 30 mg ten opzichte van de placebogroepen: MEASURE-UP 1: 15 mg (70%); 30 mg (80%) en placebo (16%), MEASURE-UP 2: 15 mg (60%); 30 mg (73%) en placebo (13%). Het andere primaire eindpunt, de proportie patiënten met een validated Investigator’s Global Assessment for Atopic Dermatitis (vIGA-AD) score van 0 (clear) of 1 (almost clear) en tevens 2 of meer stappen verbetering bij 16 weken was eveneens significant hoger in de upadacitinib groepen dan in de placebogroep, in beide studies. Daarnaast was er sprake van een snelle verbetering van jeuk in de upadacitinib groepen. De proportie patiënten met een klinisch relevante verbetering van de jeuk, was significant hoger in de upadacitinib groepen dan in de placebogroep; voor upadacitinib 30 mg na 2 dagen en voor upadacitinib 15 mg na 3 dagen, in beide studies. In beide studies lieten secundaire patiënt gerapporteerde uitkomsten, zoals pijn, kwaliteit van leven (DLQI), angst en depressie (HADS-A en HADS-D), ernst van het CE (POEM), eveneens significante verschillen zien bij 16 weken ten gunste van upadacitinib.
In een derde studie werd de effectiviteit en veiligheid van upadacitinib in combinatie met topicale corticosteroïden onderzocht, eveneens in een gerandomiseerde, dubbelblinde placebogecontroleerde fase 3 studie: AD-Up. [2] Patiënten van 12 jaar en ouder met matig tot ernstig CE werden behandeld met upadacitinib 15 mg, 30 mg of placebo (1:1:1) één keer daags in combinatie met topicale corticosteroïden in alle drie de groepen gedurende 16 weken. Na 16 weken werden de patiënten uit de placebo groep opnieuw gerandomiseerd in de groep upadacitinib 15 mg of 30 mg (1:1). Een significant grotere proportie patiënten behaalden het primaire eindpunt EASI75 bij 16 weken in de upadacitinib 15 mg + corticosteroïden groep (65%) en upadacitinib 30 mg + corticosteroïden groep (77%), ten opzichte van de placebo + corticosteroïden groep (26%). Ook de overige uitkomsten lieten een significant verschil zien ten gunste van upadacitinib op verschillende meetmomenten. [2] In een lange-termijns studie behaalde 50.8% van de patiënten in de upadacitinib 15mg behandelgroep en 69.0% van de patiënten in de upadacitinib 30 mg behandelgroep na 52 weken minimaal EASI75. Na 1 jaar behaalden respectievelijk, 33.5% en 45.2% een vIGA-AD van clear of almost clear, en wat betreft de NRS jeuk rapporteerden 45.3% in de upadacitinib 15mg behandelgroep en 57.5% in de upadacitinib 30mg behandelgroep een verbetering van 4 of meer punten. [3] Als laatste zijn de resultaten van de Heads Up studie, een gerandomiseerde multi-centrum fase 3b ‘head-to-head’ studie, gepubliceerd. [4] Deze studie vergeleek de effectiviteit en veiligheid van upadacitinib 30 mg eenmaal daags versus dupilumab 300mg om de week bij 692 volwassenen met matig tot ernstig CE. Na 16 en na 24 weken behaalde een significant groter deel van de groep die behandeld werd met upadacitinib het primaire eindpunt EASI75 (71.0%) vergeleken met de groep die behandeld werd met dupilumab (61.1%). Ook op de secundaire eindpunten (NRS jeuk, EASI90 en EASI100) scoorde de groep die behandeld werd met upadacitinib significant beter dan de groep die behandeld werd met dupilumab.
Samenvatting meest voorkomende bijwerkingen tijdens upadacitinib behandeling
De meest voorkomende bijwerkingen (≥ 2% van de patiënten) in placebo gecontroleerde studies bij patiënten met CE waren bovenste luchtweginfecties (25.4%), acne (15.1%), herpes simplex infecties (8.4%), hoofdpijn (6.3%), creatinekinase (CK) stijging (5.5%), hoesten (3.2%), folliculitis (3.2%), buikpijn (2.9%), misselijkheid (2.7%), neutropenie (2.3%), koorts (2.1%) en influenza (2.1%). [5]
Infecties
De frequentie van infecties was 39% in de upadacitinib 15 mg groep en 43% in upadacitinib 30 mg groep versus 30% in de placebo groep, over een periode van 16 weken. De frequentie van ernstige infecties was respectievelijk 0.8% en 0.4% in de upadacitinib 15 mg en 30 mg groep versus 0.6% in de placebo groep. [5]
Eczema herpeticum en herpes zoster
Bij 16 weken behandeling met upadacitinib 15 mg en 30 mg kwam eczema herpeticum in respectievelijk 0.7% en 0.8% van de patiënten voor, vergeleken met 0.4% in de placebo groep (1,8 en 1,8 voorvallen per 100 patiëntjaren). Herpes zoster infecties kwamen voor bij upadacitinib 15 mg en 30 mg upadacitinib (3.5 en 5.2 voorvallen per 100 patiëntjaren, respectievelijk), maar verliepen niet-ernstig en betroffen meestal slechts één dermatoom. [5]
Laboratorium afwijkingen
Dosis afhankelijke veranderingen in ALAT en/of ASAT (≥ 3 x bovengrens), lipiden parameters en creatinekinase (CK) waarden (> 5 x bovengrens) en neutropenie (absoluut aantal neutrofielen) < 1 x 109 cellen/L) waren geassocieerd met upadacitinib behandeling. [5]
In de studie die upadacitinib vergeleek met dupilumab werden infecties, eczema herpeticum, herpes zoster, acne, bovenste luchtweginfecties en lab afwijkingen (anemie, neutropenie, lymfopenie en verhoging van transaminasen of creatinekinase waarden) vaker gerapporteerd in de groep die behandeld werd met upadacitinib dan de groep die behandeld werd met dupilumab. Hoofdpijn en conjunctivitis werden vaker gerapporteerd in de groep die behandeld werd met dupilumab dan in de groep die behandeld werd met upadacitinib. [4]
Het navolgende standpunt is tot stand gekomen door de domeingroep allergie en eczeem van de NVDV en de Verenging van Mensen met Constitutioneel eczeem (VMCE) en bevat aanbevelingen voor het voorschrijven van upadacitinib.
Aanbevelingen
• Label/indicatie conform EMA
De Committee for Medical products for Human use (CHMP) heeft een positieve opinie gegeven t.a.v. markt autorisatie van upadacitinib als add-on voor de behandeling van volwassen patiënten en adolescenten vanaf 12 jaar met matig tot ernstig constitutioneel eczeem, die in aanmerking komen voor systemische therapie. Upadacitinib is goedgekeurd door de EMA in augustus 2021.
Indicatie/voorwaarden voor voorschrijven
De plaatsbepaling van upadacitinib binnen de richtlijn CE is nog niet vastgesteld en zal meegenomen worden in de revisie van het hoofdstuk systemische therapie in 2022. Gezien de vergelijkbare positie als dupilumab, baricitinib en tralokinumab (add-on geneesmiddelen) adviseert de domeingroep voor upadacitinib dezelfde voorwaarden te hanteren (zie figuur 1).
De volgende vier voorwaarden zijn opgesteld om upadacitinib te mogen voorschrijven bij patiënten van 12 jaar en ouder:
1. Het ziekenhuis/behandelcentrum geeft aantoonbaar instructie en begeleiding bij zalftherapie door verpleegkundigen en/of doktersassistenten middels aparte spreekuren.
2. De dermatoloog heeft ervaring met het voorschrijven en monitoren van minstens twee van de volgende systemische medicatie: ciclosporine, azathioprine, methotrexaat, mycofenalaat mofetil (MMF)/mycofenolzuur (MPA).
3. Het ziekenhuis/behandelcentrum/dermatoloog is bereid het effect van de behandeling te volgen en vast te leggen in het dossier.
4. Upadacitinib is geïndiceerd voor adolescenten (12-17 jaar) met CE, die onvoldoende respons hebben op intensieve lokale therapie die gepaard is gegaan met goede instructie en begeleiding, of wanneer het niet mogelijk is de lokale therapie af te bouwen naar een veilig onderhoudsschema conform de Leidraad Dermatocorticosteroïden. Dit is de populatie adolescenten die behandeld wordt of in aanmerking komt voor systemische immunosuppressieve /immuno-modulerende therapie.
5. Upadacitinib is geïndiceerd voor volwassenen (≥ 18 jaar) met CE indien het eczeem niet goed genoeg onder controle is ondanks optimale zalftherapie én een periode van minimaal 4 maanden behandeling met een of meer conventionele immunosuppressiva (ciclosporine, azathioprine, methotrexaat, mycofenolaat mofetil/mycofenolzuur) in een afdoende dosis, tenzij er contra-indicaties zijn of bijwerkingen zijn van deze middelen.
De domeingroepen allergie en eczeem en kinderdermatologie adviseren indicatiestelling en start van upadacitinib bij adolescenten van 12-17 jaar te beperken tot gespecialiseerde centra voor de behandeling van CE bij kinderen, te weten de afdelingen dermatologie van het UMC Amsterdam (locatie AMC), UMC Utrecht (WKZ), Erasmus MC, UMC Groningen, Radboudumc Nijmegen, UMC Maastricht en Leiden UMC.
Registratie in landelijk register
De domeingroepen allergie en eczeem adviseert de patiënten die starten met upadacitinib in het kader van CE zoveel mogelijk op te nemen in één van de twee landelijke registers, te weten BioDay (www.bioday.nl) of TREAT NL (www.treatregister.nl).
Dosering
- De aanbevolen dosis van upadacitinib voor volwassen patiënten (≥ 18 jaar) is 15 mg of 30 mg.
- Een dosis van 30 mg eenmaal daags zou gebruikt kunnen worden bij patiënten met een hoge ziektelast of patiënten met onvoldoende respons op 15 mg.
- Voor onderhoud moet de laagste effectieve dosis worden overwogen.
- De aanbevolen dosis upadacitinib voor patiënten ≥ 65 jaar is 15 mg éénmaal daags.
- De aanbevolen dosis upadacitinib voor adolescenten van 12 tot en met 17 jaar met een gewicht van tenminste 30 kg, is 15 mg éénmaal daags.
- De behandeling met upadacitinib mag niet worden gestart of moet onderbroken worden bij patiënten met een absoluut aantal lymfocyten <0.5 x 109cellen/L, een absoluut aantal neutrofielen <1 x 109 cellen/L of een hemoglobine van < 5 mmol/L.
- Upadacitinib kan worden voorgeschreven in combinatie met, of zonder topicale corticosteroïden
- Indien er geen effect is opgetreden na 12 weken behandeling met upadacitinib dient overwogen te worden om de behandeling te staken.
Dosisaanpassing
- De behandeling dient gestopt te worden bij patiënten met een absoluut lymfocyten aantal < 0,5 x 109 cellen/L, een absoluut neutrofielen aantal < 1 x 109 cellen/L, Hemoglobine <5 mmol/L. De behandeling kan (weer) worden ingesteld zodra de waarden tot boven deze limieten hersteld zijn.
- Er zijn beperkte data van upadacitinib bij ernstige nierinsufficiëntie. Hierbij zou uitsluitend upadacitinib 15 mg per dag gebruikt mogen worden, onder strikte controle. Bij milde tot matige nierinsufficiëntie is geen dosisaanpassing noodzakelijk. Het gebruik van upadacitinb in patiënten met eindstadium nierfalen is niet onderzocht en wordt daarom niet aanbevolen.
- Bij patiënten met chronische of recidiverende infecties dient dosisaanpassing of staken overwogen te worden.
- Behandeling met upadacitinib mag niet worden gestart of moet worden onderbroken wanneer een patiënt een ernstige actieve infectie ontwikkelt, en mag weer hervat worden als de infectie onder controle is.
Contra-indicaties:
- Overgevoeligheid voor een van de bestanddelen
- Actieve tuberculose (TB) of een actieve ernstige infectie
- HIV, Hepatitis B/C
- Ernstige leverfunctiestoornis
- Zwangerschap of zwangerschapswens bij vrouw
- Tijdens het geven van borstvoeding
- Maligniteiten in de voorgeschiedenis met uitzondering van nonmelanoma skin cancer (NMSC)
- Recente of geplande vaccinatie met levend vaccin
Speciale waarschuwing/voorzorgsmaatregelen
- De behandeling dient tijdelijk onderbroken te worden wanneer er door upadacitinib een verhoging van de leverenzymen ontstaat en er een verdenking is op leverschade.
- Wees voorzichtig bij patiënten met verhoogd risico op diepveneuze trombose (DVT) en longembolie. DVT en longembolie zijn gemeld bij gebruik van JAK-remmers zoals upadacitinib. Risicofactoren voor DVT en longembolie zijn oudere leeftijd, obesitas, een voorgeschiedenis van DVT of longembolie, een grote chirurgische ingreep en langdurige immobilisatie.
- Er is weinig ervaring bij ouderen >75 jaar.
Monitoring
Omdat de JAK remmers nog niet opgenomen zijn in de landelijke richtlijn CE, is er nog geen specifiek monitor-protocol voor patiënten met CE. Op basis van veiligheidsinformatie uit studies bij CE en monitor-protocollen bij RA heeft de domeingroep het volgende monitor-protocol opgesteld voor upadacitinib:
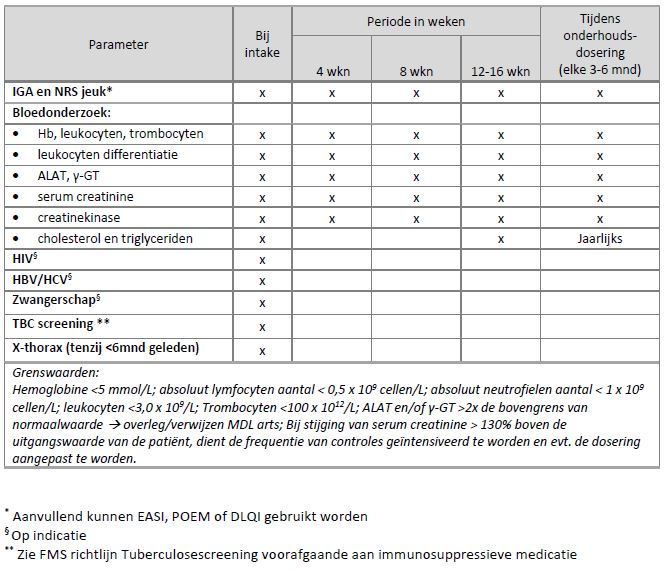
Zwangerschap en kinderwens
De JAK/STAT-route blijkt een rol te spelen bij celadhesie en cel polariteit wat van invloed kan zijn op de vroegembryonale ontwikkeling. Vrouwen die zwanger kunnen worden, moeten effectieve anticonceptie gebruiken tijdens en tot minstens vier weken na laatste dosis. Als een patiënte tijdens het gebruik van upadacitinib zwanger wordt, dient direct gestopt te worden en moet zij worden geïnformeerd over het potentiële risico voor de foetus.
Borstvoeding
Risico voor pasgeboren/zuigelingen kan niet worden uitgesloten en upadacitinib dient niet te worden gebruikt tijdens de periode van borstvoeding.
Fertiliteit
Het effect van upadacitinib op de fertiliteit in mensen is niet onderzocht. Dierstudies hebben geen effect op de fertiliteit aangetoond.
Carcinogenese
Immunomodulerende medicamenten kunnen mogelijk het risico op maligniteiten, inclusief lymfomen, vergroten. De klinische data is momenteel nog beperkt. De risico’s en voordelen van upadacitinib behandeling dienen overwogen te worden voor het starten van de behandeling bij patiënten met een maligniteit in de voorgeschiedenis (anders dan non-melanoma skin cancer (NMSC)). Periodiek onderzoek van de huid wordt daarom aangeraden voor patiënten met een verhoogd risico op huidkanker.
Vaccinaties
Er is geen data beschikbaar over de respons op vaccins met levende of levend-verzwakte vaccins in patiënten die behandeld worden met upadacitinib. Het wordt derhalve afgeraden levende of levend-verzwakte vaccins toe te dienen tijdens of net voor de behandeling met upadacitinib. Voor start behandeling wordt geadviseerd een reisanamnese af te nemen.
Onderbouwing
In herziene de richtlijn CE (2019) is in het hoofdstuk over systemische therapie een algoritme opgenomen voor starten van systemische therapie, waarbij alle conventionele immunosuppressiva en dupilumab zijn opgenomen.
Upadacitinib is de tweede JAK-remmer die geregistreerd gaat worden voor de behandeling van volwassen patiënten met matig tot ernstig CE en de eerste JAK-remmer voor kinderen met matig tot ernstig CE. De werkzaamheid van upadacitinib bij adolescenten van 12-17 jaar en bij volwassen patiënten met CE is uitgebreid onderzocht in grote studies waarbij het middel effectiever is gebleken dan placebo behandeling, zowel als monotherapie als in combinatie met topicale steroïden. Ook was upadacitinib effectiever op klinische en patiënt gerapporteerde eindpunten vergeleken met dupilumab. Gezien de nog beperkte systemische behandelopties voor patiënten met matig tot ernstig CE is upadacitinib een belangrijke aanvulling op het therapeutisch arsenaal bij deze patiëntengroep.
Gezien de vergelijkbare positie met dupilumab, baricitinib en tralokinumab (add-on geneesmiddel) adviseren de NVDV (domeingroep allergie en eczeem) en de Vereniging voor Mensen met Constitutioneel Eczeem (VMCE) om upadacitinib nevengeschikt te positioneren naast dupilumab, baricitinib en tralokinumab in het behandel-algoritme voor systemische therapie voor CE. Voor het voorschijven gelden dus dezelfde voorwaarden als voor dupilumab, baricitinib en tralokinumab (zie figuur 1).
Samen beslissen
Na de introductie van upadacitinib zijn er voor volwassen patiënten met CE na falen lokale therapie én conventionele systemische therapie (CsA, MTX, AZA en MMF) vier nieuwe middelen die vooralsnog nevengeschikt zijn: dupilumab, baricitinib, tralokinumab en upadacitinib. In de afweging voor de keuze is het van belang om in het proces van ‘samen beslissen’ de voor- en nadelen (benefits/harms) van beide duidelijke te benoemen, te bezien vanuit de persoonlijke context en voorkeuren van de patiënt en eventuele comorbiditeiten. Over die voor- en nadelen per middel moet in de praktijk bij diverse patiëntengroepen nog meer duidelijkheid ontstaan, liefst gemonitord in de landelijke eczeem registers BioDay of TREAT NL.
Figuur 1: aangepast behandel algoritme systemische therapie bij CE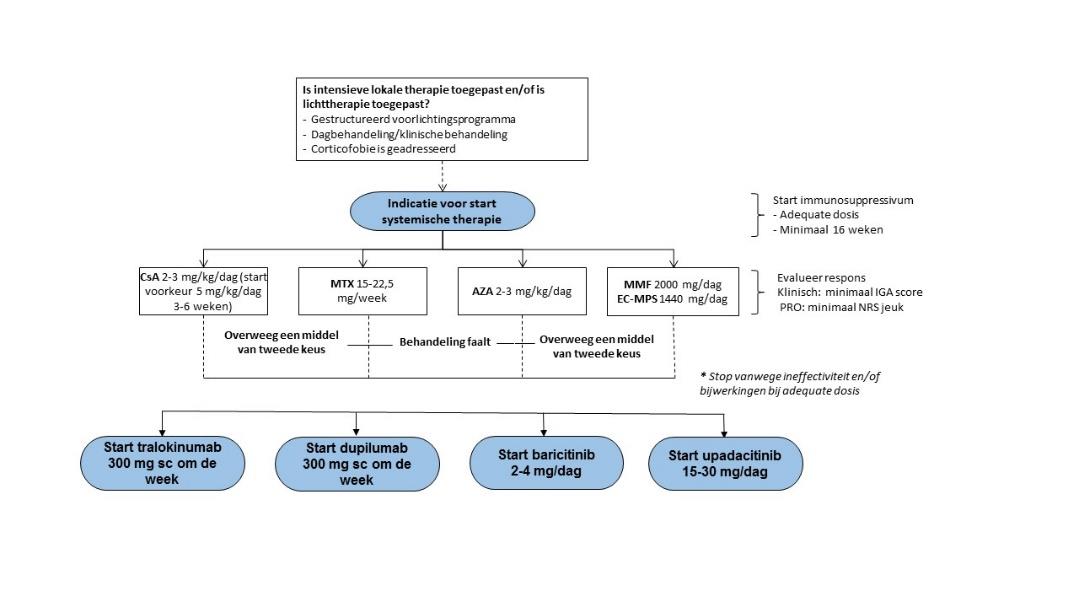
Literatuur
[1] E. Guttman-Yassky et al., “Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials.,” Lancet (London, England), vol. 397, no. 10290, pp. 2151–2168, Jun. 2021.
[2] K. Reich et al., “Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial.,” Lancet (London, England), vol. 397, no. 10290, pp. 2169–2181, Jun. 2021.
[3] J. I. Silverberg et al., “Upadacitinib plus topical corticosteroids in atopic dermatitis: week-52 AD Up study results.,” J. Allergy Clin. Immunol., Aug. 2021.
[4] A. Blauvelt et al., “Efficacy and Safety of Upadacitinib vs Dupilumab in Adults With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial,” JAMA Dermatology, Aug. 2021.
[5] “SUMMARY OF PRODUCT CHARACTERISTICS RINVOQ.” [Online]. Available: AbbVie productinformatie [Accessed: 26-Aug-2021]