Artikelen
Artikelen - Zorg voor kind geboren met giant congenitale melanocytaire naevus (2019-01)
E. Burkink, L.E.M. de Wijs, S.G.M.A. Pasmans, I.F. Nagtzaam
Congenitale melanocytaire naevi (CMN) bestaan uit (epi)dermale nesten van benigne melanocytaire proliferaties die afkomstig zijn uit de neurale kam. CMN zijn aanwezig bij de geboorte of verschijnen in de eerste levensweken tot en met de leeftijd van drie maanden. [1-5] Geadviseerd wordt de krengelclassificatie te gebruiken die uitgaat van de verwachte grootte op volwassen leeftijd (projected adult size [PAS]) en een andere risicoclassificatie, eveneens op basis van grootte van de naevus (I-V) (tabel 1). [1,6,7]
Giant congenitale melanocytaire naevi (GCMN) hebben een diameter van minimaal 40 cm. De geschatte incidentie is 1 op 20.000 tot 500.000 van de levendgeborenen en ze worden vaker gezien bij meisjes dan bij jongens. [8] Er is een associatie tussen (G)CMN en het maligne melanoom (MM) en neurocutane melanosis (NCM). Deze associatie is niet zo sterk als eerder beschreven, met een huidige incidentie van MM < 5% en NCM 2,5-45% bij patiënten met GCMN. Grootte van de CMN en de aanwezigheid van satellietnaevi spelen hierbij een prognostische rol, op basis waarvan een risicoclassificatie naar omvang (I-V) plaatsvindt. [1,9,10]
Overmatige aanwezigheid van naevuscellen kunnen behalve in de huid ook in het centrale zenuwstelsel voorkomen. Bij symptomatische betrokkenheid van huid én zenuwstelsel spreekt men van NCM. Er kan dan sprake zijn van benigne en maligne melanocytaire proliferaties in de leptomeningen en het hersenparenchym. Indien symptomen ontstaan, meestal voor de leeftijd van 3 jaar, is de prognose slecht en de mortaliteit hoog. Oorzaken hiervan zijn meestal een complicatie van een hydrocefalus of ontwikkeling van maligne melanoom in het centrale zenuwstelsel. [3]
Ten slotte zijn GCMN vaak geassocieerd met de ontwikkeling van proliferatieve noduli in de huid (PN). Deze PN zijn benigne proliferaties die vaak verward worden met een maligne melanoom. [3]
Tabel 1. Indeling risicoklassen.

Hier presenteren we een casus van een jongen met een GCMN, voornamelijk gelokaliseerd op de romp. Gezien de grootte van de laesie en de nieuwe multidisciplinaire richtlijn CMN, bespreken we de aanpak van deze GCMN.
Casus
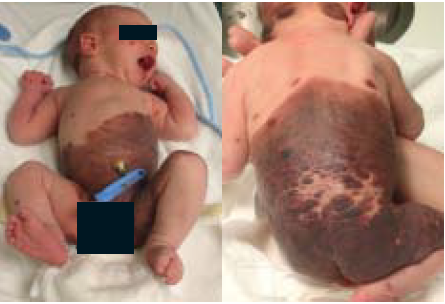
Kort na de geboorte werd een à terme geboren jongen poliklinisch vanuit een perifeer ziekenhuis verwezen naar ons academisch ziekenhuis (MUMC+). Hij werd geboren met mul- tipele bruine maculae en plaques verspreid over zijn lichaam (figuur 1A). Er was een negatieve familieanamnese voor CMN. De naevus was > 60 cm PAS met zo’n 20-50 satellieten (G2).
Vanwege duidelijke kleurheterogeniteit (C2), licht ruw/geplooid oppervlak (R1), enkele verspreide dermale en subcutane noduli (N1) en afwezigheid van hypertrichosis (H0) werd deze huidafwijking geclassificeerd als G2S2C2R1N1H0. [1,7] Bij onze patiënt bestonden er geen tekenen van NCM.
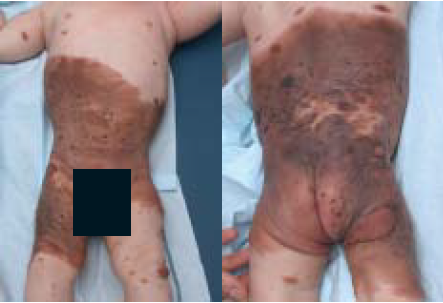
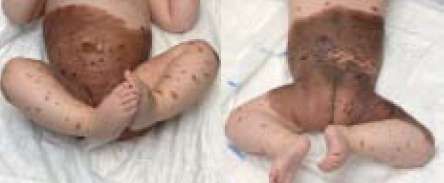
De ouders van onze patiënt kregen uitleg over de aard van de aandoening, kregen informatie mee naar huis (https://www.huidhuis.nl/huidaandoening/moedervlek-aan- geboren) en werden op de hoogte gebracht van de patiëntenvereniging Naevus Netwerk (https://www.nevusnetwerk.nl). Ook werd de patiënt multidisciplinair transmuraal, deels digi- taal via het CMN specifiek persoonlijk gezondheidsdossier in Huidhuis.nl vervolgd in het expertisecentrum in het Sophia Kinderziekenhuis te Rotterdam. Dit gebeurde alternerend met driemaandelijkse controles dichter bij huis in het MUMC+ te Maastricht. Hierbij werd een anamnese verricht en lichamelijk onderzoek uitgevoerd met inspectie en palpatie van de naevi en lymfeklieren en fotodocumentatie. De progressieve ontwik- keling van nieuwe bruine papels, plaques en subcutane noduli zijn gediagnosticeerd als PN (figuur 1B,C).
In het expertisecentrum van het Sophia Kinderziekenhuis werden op verzoek van de ouders vanwege cosmetische redenen onlangs enkele full thickness-excisies verricht van satellietlaesies (figuur 2).
Bespreking behandeling van de cmn
Er heerste tot de ontwikkeling van de nieuwe richtlijn veel discussie over de behandeling van CMN vanwege het ontbreken van grote gerandomiseerde studies en het ontbreken van bewijs over de kwaliteit en effectiviteit van de behandeling.
Behandeling werd uitgevoerd vanwege cosmetische redenen en daarnaast het reduceren van het risico op het ontstaan van cutane maligniteiten, alhoewel significant bewijs hiervoor ontbreekt. [8,10]
Incidentie van maligne melanoom is bij GCMN gemiddeld < 5% met de hoogste kans op ontstaan vóór de puberteit. [3,8] Risicofactoren voor het ontwikkelen van een maligne melanoom zijn: naevi > PAS 20 cm (vooral > PAS 60 cm [8,13]), meerdere satellietlaesies, lokalisatie op de romp en irregulaire morfologie (vanwege moeilijkheid klinisch/histologisch onderscheid te maken tussen benigne en maligne). [3,8,11]
Een maligne melanoom uit zich vaak als hyper- of hypopigmentatie, verhevenheid of ulceratie. [1] CMN < 10 cm behoeven geen follow up, zie ook de richtlijn voor follow-upadviezen.
Bij het fenotype van onze patiënt (risicoklasse IV) hoort volgens de richtlijn CMN een verhoogd risico op een cutaan MM (9%) en NCM (> 2%), waarbij er sprake is van een hoge chirurgi- sche complexiteit. Er wordt een periodieke dermatologische controle in een expertisecentrum (gedurende eerste levensjaar eens per drie maanden, daarna levenslang een- tot tweemaal per jaar) en controle door een kinderarts in een perifeer ziekenhuis (tot de leeftijd van 5 jaar) aanbevolen. Patiënt zou daarnaast kort na de geboorte naar een plastisch chirurg in een expertisecentrum verwezen moeten worden in verband met voorlichting over behandelopties. Verder kan er ook over- wogen worden om een psycholoog in de follow-up te betrek- ken bij psychisch lijden voor de ouders in eerste instantie en later voor het kind zelf als gevolg van de GCMN. [3]
Eerder was chirurgie de meest geaccepteerde behandeling van CMN, tegenwoordig wordt watchful waiting tot de leeftijd van 3 jaar aanbevolen indien geen van de benoemde risicofactoren aanwezig zijn. Dit betekent periodieke inspectie, palpatie van de laesie en lymfeklieren en fotodocumentatie. Dermatoscopisch onderzoek blijkt niet van meerwaarde bij CMN. [1] Daarnaast is controle door de kinderarts geïndiceerd. Bij een mogelijk verdachte nieuw ontstane of veranderde afwijking binnen de laesie wordt een gelokaliseerde diagnostische excisie aanbevolen (binnen 2 weken). [1]
Deze verandering van aanpak wordt onder andere geadviseerd vanwege het steeds lager ingeschatte risico op het ontwikke- len van een melanoom in de betreffende laesie en mogelijke bijwerkingen van anesthesie bij baby’s. [4,8] Daarnaast blijkt dat de meerderheid (65%) van de onbehandelde naevi spontaan lichter van kleur wordt en 28% van de chirurgisch behan- delde patiënten nieuwe pigmentatie krijgt in het behandelde gebied. [12] Chirurgie is echter nog wel de gouden standaard bij patiënten met functionele klachten zoals pruritis of intertrigo en cosmetische dan wel psychosociale problemen. [4,8] Er kan dan gekozen worden voor een full-thickness- of partial- thickness-behandeling waarbij er nog geen duidelijkheid bestaat over het verschil in cosmetiek en complicatierisico.
De voorkeur gaat voor alsnog uit naar full-thickness excision. [1] Uiteindelijk is het doel een individuele aanpak waarbij multi- pele componenten worden meengenomen door het multidisciplinaire expertiseteam bij het, samen met de ouders, nemen van een beslissing voor de therapie van keuze.
 A
A
 B
B
 C
C
Figuur 1. Kliniek van de GCMN. A. Bij de geboorte. B. Na zes maanden.
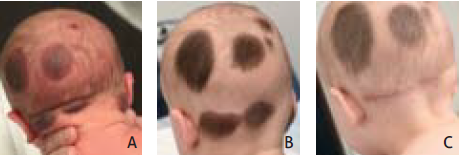
Figuur 2. Achterzijde van het hoofd. A. Bij de geboorte. B. Na zes maanden. C. Bij veertien maanden kort na ‘full-tickness’-excisie van twee satelliet- laesies.
Bij follow-up moet er speciale aandacht zijn voor inspectie en palpatie van de laesies en lymfeklieren.
Wat betreft het management rondom NCM: er dient laagdrempelig een MRI met contrast uitgevoerd te worden indien er enige aanwijzingen zijn voor het bestaan of ontwikkelen van NCM. Aanwijzingen kunnen zijn: verhoogde intracraniële druk en daarbij behorende verschijnselen, focale afwijkingen, tekenen van compressie van het ruggenmerg en stagneren van de algehele ontwikkeling. [1] De MRI-beelden dienen dan te worden beoordeeld in een expertisecentrum. Het gebruik van een MRI als screeningprocedure bij asymptomatische patiënten is controversieel en wordt niet aanbevolen door de werkgroep betrokken bij de richtlijn, vooral omdat er geen bewezen levensverlengende behandeling bestaat voor NCM. [1,3]
Conclusie
Behandeladviezen zijn soms controversieel vanwege ontbrekende bewijzen. Inherente risico’s en mogelijke voordelen moeten individueel afgewogen worden voor optimale behandeling. Bij follow-up moet er speciale aandacht zijn voor inspectie en palpatie van de laesies en lymfeklieren.
Follow-up voor CMN < 10 cm PAS en screening voor NCM met MRI zonder klachten worden niet aanbevolen. Het is belan rijk risicoprofielen te maken om zodoende goed advies voor behandeling en follow up te geven (richtlijn Congenitale melanocytaire naevi). [1]
Literatuur
- Multidisciplinaire Nederlandse landelijke richtlijn Congenitale Melanocytaire Naevi (CMN) 2016 van Nederlandse Vereniging voor Dermatologie en Venereologie. Te raadplegen via: https://www.huidhuis.nl/sites/huidhuis.nl/files/inline-images/PDF/Definitieve%20- richtlijn%20CMN.pdf (samenvatting voor poli: https://www.huid- huis.nl/sites/huidhuis.nl/files/inline-images/PDF/Spreekkamerproto col%20_CMN.pdf)
- Eggen CAM, Pasmans SGMA. Congenitale melanocytaire naevi (CMN). Ned Tijdschr Dermatol Venereol 2017;27(05):227-40.
- Alikhan A, Ibrahimi O, Eisen D. Congenital nevi: where are we now (part I). Clinical presentation, epidemiology, pathogenesis, histology, malignant transformation, and neurocutaneous melanosis. J Am Acad Dermatol 2012;67(4):495.e1-17.
- Alikhan A, Ibrahimi O, Eisen D. Congenital nevi: where are we now (part II). Part II. Treatment options and approach to treatment. J Am Acad Dermatol 2012;67(4):515.e1-13.
- Viana A, Gontijo B, Bittencourt F. Giant congenital melanocytic nevus. An Bras Dermatol 2013;88(6):863-78.
- Kopf A, Bart R, Hennessey P. Congenital nevocytic nevi and malignant melanomas. J Am Acad Dermatol 1979;1:123-30.
- Krengel S, Scope A, Dusza SW, Vonthein R, Marghoob AA. New recom- mendations for the categorization of cutaneous features of congeni- tal melanocytic nevi. J Am Acad Dermatol 2013;68(3):441-51.
- Arad E, Zuker R. The shifting paradigm in the management of giant congenital melanocytic nevi: review and clinical applications. Plast Reconstr Surg 2014;133(2):367-76.
- Watt AJ, Kotsis SV, Chung KC. Risk of melanoma arising in large congenital melanocytic nevi: a systematic review. Plast Reconstr Surg 2004;113(7):1968-74.
- Krengel S, Hauschild A, Schafer T. Melanoma risk in congenital melanocytic naevi: a systematic review. Br J Dermatol 2006;155(1):1-8.
- Su JJ, Chang DK, Mailey B, Gosman A. Treatment of a giant congenital melanocytic nevus in the adult: review of the current management of giant congenital melanocytic nevus. Ann Plast Surg 2015;74(1):S57-61.
- Kinsler VA, Birley J, Atherton DJ. Great Ormond Street Hospital for Children registry for congenital melanocytic naevi: prospective study 1988-2007. Part 2 – evaluation of treatments. Br J Dermatol 2009;160(2):387-92.
- Bittencourt FV, Marghoob AA, Kopf AW, Koenig KL, Bart RS. Large congenital melanocytic nevi and the risk for development of malig- nant melanoma and neurocutaneous melanocytosis. Pediatrics 2000;106(4):736-41.
Samenvatting
Wij beschrijven een pasgeborene met een giant congenitale melanocytaire naevus (GCMN). GCMN hebben een diameter van ten minste 40 centimeter op volwassen leeftijd, kunnen een zeer heterogeen fenotype vertonen en worden geassocieerd met maligne melanoom (MM) en neurocutane melanose (NCM). Door middel van het opstellen van classificatie en een risicoprofiel, volgens de nieuwe richtlijn Congenitale melanocytaire naevi kan aan ouders een plan van aanpak worden geadviseerd wat betreft diagnostiek, behandeling en follow-up.
Summary
We describe a newborn child with a giant congenital melanocytic naevus (GCMN). GCMN have a diameter of at least 40 centimeters (projected adult size), can have a very heterogeneous phenotype and are associated with malignant melanoma (MM) and neurocutaneous melanosis (NCM). By classification and by creating a risk profile, according to the new guideline ‘congenital melanocytic naevi’, parents were advised regarding further diagnostic evaluation, treatment and follow-up.
Trefwoorden
congenitale melanocytaire naevus – giant congenitale melanocytaire naevus – neurocutane melanose – maligne melanoom – aangeboren moedervlek
Keywords
congenital melanocytic nevus – giant congenital melanocytic nevus – neurocutaneous melanosis – maligna melanoma
Correspondentieadres
Esther Burkink
E-mail: eshter.burkink@mumc.nl